
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:多选题
| A. | NH${\;}_{4}^{+}$ | B. | Mg2+ | C. | Fe2+ | D. | Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
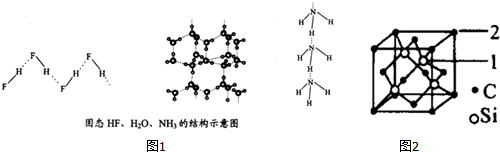
| 物质 | 氢键X-H…Y | 键能KJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| B. | CO2通入Na2SiO3稀溶液中,生成白色胶状沉淀硅酸 | |
| C. | 高温下SiO2与碳酸盐反应生成CO2 | |
| D. | HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
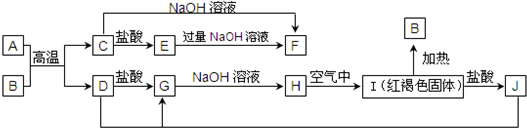
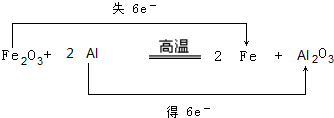 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率v(Cl2)=0.0016 mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则该反应的△H<0 | |
| C. | 温度为T时,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| D. | 温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com