
分析 (1)碳酸铵和碳酸氢铵加人足量的氢氧化钠反应方程式为2NaOH+(NH4)2CO3═2NH3↑+2H2O+Na2CO3,2NaOH+NH4HCO3═NH3↑+2H2O+Na2CO3,设碳酸铵和碳酸氢铵的物质的量分别为xmol和与ymol,则96x+79y=12.7①,根据氮原子守恒2x+y=$\frac{4.48}{22.4}$②,解x,y据此进行分析;
(2)w=$\frac{m(N)}{m}×100%$,据此进行计算.
解答 解:(1)碳酸铵和碳酸氢铵加人足量的氢氧化钠反应方程式为2NaOH+(NH4)2CO3═2NH3↑+2H2O+Na2CO3,2NaOH+NH4HCO3═NH3↑+2H2O+Na2CO3,设碳酸铵和碳酸氢铵的物质的量分别为xmol和与ymol,则96x+79y=12.7①,根据氮原子守恒2x+y=$\frac{4.48}{22.4}$②,解得x=0.05mol,y=0.01mol,故n((NH4)2CO3)=0.05mol,n(NH4HCO3)=0.1mol,
答:12.7g样品中碳酸氢铵的物质的量为0.1mol;
(2)m(N)=n(N)M=(0.05mol×2+0.1mol)×14g/mol=2.8g,
w=$\frac{m(N)}{m}×100%$=$\frac{2.8g}{12.7g}×100%$=22.05%,
答:12.7g样品中氮元素的百分含量为22.05%.
点评 本题属于混合物的计算,注意元素守恒在计算过程中的应用,本题题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

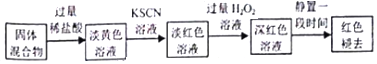
| 实验 | 操作 | 现象 | |
| 实验Ⅰ (取褪色后溶液3等份) | 第1份 | 滴加FeCl2溶液 | 无明显变化 |
| 第2份 | 滴加KSCN溶液 | 溶液出现红色 | |
| 第3份 | 滴加稀盐酸和BaCl2溶液 | 产生白色沉淀 | |
| 实验Ⅱ (取与褪色后的溶液同浓度的FeCl3溶液) | 滴加2滴KSCN溶液,溶液变红,再通入O2 | 无明显变化 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +184.6 kJ/mol | B. | -92.3 kJ/mol | C. | -369.2 kJ/mol | D. | +92.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N-H | N≡N |
| 键能kJ/mol | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+一定存在 | B. | 溶液中CO32-浓度为0.1 mol/L | ||
| C. | Cl-可能存在 | D. | Ba2+一定不存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com