
����Ŀ��ijͬѧ�������ʵ�飬���о��������������ʣ�
ʵ��һ����ͼ1����һ֧�Թ��з���һ���С��ͭƬ���ټ���2mLŨ���ᣬȻ����Թ̶ܹ�������̨�ϣ���һС��պ��Ʒ����Һ����ֽ������е�����Ƥ���IJ������У������Թܿڣ��ڲ����ܿڴ�����һ��պ��Na2CO3��Һ���������Թܼ��ȣ��۲������Թ��е�Һ������ʱ��ֹͣ���ȣ����Թ��е�Һ����ȴ���Թ��е�Һ������������һ֧ʢ������ˮ���Թ��У��۲�����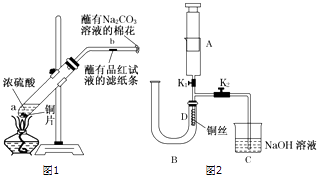
�ش��������⣺
��1��a����Ӧ�Ļ�ѧ����ʽΪ �� ����ų�112mL���壨��״������ת�Ƶ��ӵ����ʵ���Ϊ ��
��2���Թ��е�Һ�巴Ӧһ��ʱ���b����ֽ���ı仯Ϊ ��
���Թ��з�Ӧֹͣ�������ܷ���պ��Ʒ����Һ����ֽ�����ȣ���ֽ���ı仯Ϊ ��
��3��ʵ�����Ϊ��֤��ͭ��ϡ���ᷴӦ����һ��������ijͬѧ�����һ��ʵ�飬��װ����ͼ2��ʾ������װ�ú̶�װ�þ�����ȥ����AΪע������BΪ���˳��̲��ȵ�U�ιܣ�C��װ��NaOH��Һ���ձ���D�����Ƴ�����״��ͭ˿��K1��K2��ֹˮ�У�
��ʵ��ʱ��Ϊ��D���ռ���NO���Ա�۲���ɫ������������A������һ�����Ŀ�����Ȼ��K1�����رա���������U�ι����ע��ϡ���ᣬ�������������ȷ��U�ι��п����ѱ��Ͼ���
��4��Ȼ���װ��B���ȣ���װ��D��������ɫ���壬�䷴Ӧ�����ӷ���ʽΪ�� ��
��5�����֤��D���ۼ�����NO������H2�� ��
���𰸡�
��1��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��0.01 mol
CuSO4+SO2��+2H2O��0.01 mol
��2��պ��Ʒ����Һ����ֽ����ɫ����ֽ���
��3���رգ�U�ι��Ҷ�ϡ����Ӵ�����
��4��3Cu+8H++2NO3���T3Cu2++2NO��+4H2O
��5����ֹˮ��K1 �� ��ע�����еĿ���ѹ��U�ι��У����۲쵽D����������ɫ����֤���ռ�����NO��������H2
���������⣺ʵ��һ����1��Ũ�������ǿ�����ԣ��ܺ�ͭ��Ӧ����ͭ��ԭΪ�����������Բ��������ɵ�����ͭ�����������ˮ����д��ѧ����ʽΪ��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��ͭ�Ļ��ϼ�����2��ʧȥ�������ӣ���������Ļ��ϼ۽���2�۵õ��������ӣ�����1mol��������ת��2mol���ӣ��ַų�112mL���壨��״����������n��SO2��=
CuSO4+SO2��+2H2O��ͭ�Ļ��ϼ�����2��ʧȥ�������ӣ���������Ļ��ϼ۽���2�۵õ��������ӣ�����1mol��������ת��2mol���ӣ��ַų�112mL���壨��״����������n��SO2��= ![]() =5��10��3mol��ת��5��10��3mol��2=0.01mol���ӣ����Դ��ǣ�Cu+2H2SO4��Ũ��
=5��10��3mol��ת��5��10��3mol��2=0.01mol���ӣ����Դ��ǣ�Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2��+2H2O��0.01 mol����2�����������ܺ���ɫ����������ɫ���ʣ�����������ʹƷ����Һ��ɫ�����Զ����������Ư���ԣ������ɵ���ɫ���ʲ��ȶ�������ʱ��ָ�ԭ������ɫ����ֽ��죬���Դ��ǣ�պ��Ʒ����Һ����ֽ����ɫ����ֽ��죻ʵ�������3����A������һ�����Ŀ�����Ȼ��ر�K1 �� ��ֹˮ��K2 �� ʹͭ��ϡ���ᷴӦ���ɵ�һ���������뼯��ƿ����U�ι��Ҷ�ϡ����Ӵ�����ʱ������ȷ��U�ι��п����ѱ��Ͼ������Դ��ǣ��رգ�U�ι��Ҷ�ϡ����Ӵ���������4��ϡ������ͭ��Ӧ��������ͭ��NO����Ӧ�����ӷ���ʽΪ��3Cu+8H++2NO3���T3Cu2++2NO��+4H2O�����Դ��ǣ�3Cu+8H++2NO3���T3Cu2++2NO��+4H2O����5��B�������ͭ��Ӧ����NO������������Ӧ����A�п���ѹ��B�У����к���ɫ�������ɣ�����۲쵽����ɫ����˵������NO���������������Դ��ǣ���ֹˮ��K1 �� ��ע�����еĿ���ѹ��U�ι��У����۲쵽D����������ɫ����֤���ռ�����NO��������H2 ��
CuSO4+SO2��+2H2O��0.01 mol����2�����������ܺ���ɫ����������ɫ���ʣ�����������ʹƷ����Һ��ɫ�����Զ����������Ư���ԣ������ɵ���ɫ���ʲ��ȶ�������ʱ��ָ�ԭ������ɫ����ֽ��죬���Դ��ǣ�պ��Ʒ����Һ����ֽ����ɫ����ֽ��죻ʵ�������3����A������һ�����Ŀ�����Ȼ��ر�K1 �� ��ֹˮ��K2 �� ʹͭ��ϡ���ᷴӦ���ɵ�һ���������뼯��ƿ����U�ι��Ҷ�ϡ����Ӵ�����ʱ������ȷ��U�ι��п����ѱ��Ͼ������Դ��ǣ��رգ�U�ι��Ҷ�ϡ����Ӵ���������4��ϡ������ͭ��Ӧ��������ͭ��NO����Ӧ�����ӷ���ʽΪ��3Cu+8H++2NO3���T3Cu2++2NO��+4H2O�����Դ��ǣ�3Cu+8H++2NO3���T3Cu2++2NO��+4H2O����5��B�������ͭ��Ӧ����NO������������Ӧ����A�п���ѹ��B�У����к���ɫ�������ɣ�����۲쵽����ɫ����˵������NO���������������Դ��ǣ���ֹˮ��K1 �� ��ע�����еĿ���ѹ��U�ι��У����۲쵽D����������ɫ����֤���ռ�����NO��������H2 ��


 ��Уͨ��֤��Ч��ҵϵ�д�
��Уͨ��֤��Ч��ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������������ء����������������
A.���Ͻ�������ڸ�������B.����ʱ����14C�ⶨһЩ��������
C.Ư�۾���������Ӿ�صȳ�����������D.�����ƿ��ں������DZˮͧ����Ϊ��������Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼװ�ý���ʵ�飬��Һ��A��μ��뵽����B�У�����������ȷ����
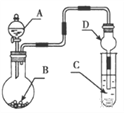
A. ��AΪH2O2��BΪMnO2��C��ʢ��Na2S��Һ�� C����Һ�����
B. ��AΪŨ���ᣬBΪMnO2��C��ʢ��KI������Һ��C����Һ����ɫ
C. ��AΪŨ��ˮ��BΪ��ʯ�ң�C��ʢ��AlCl 3��Һ�� C���Ȳ�����ɫ������������ܽ�
D. ��AΪŨH2SO4 ��BΪCaCO3��C��ʢ��Na2SiO3 ��Һ��C����Һ���ְ�ɫ������֤���ǽ�����S��C��Si
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ⱥ��ʳ��ˮ������Һ�����ѭ��ʹ�ú�ClO����ClO3-���������ӡ�
��֪����.NaHCO3����50����ʼ�ֽ⣬����Һ�зֽ��¶ȸ��͡�
��.���������£�ClO����ǿ�����ԣ�ClO3-�����ȶ���
��.���������£�ClO3-��Fe2+��ԭΪCl����MnO4-��Fe2+��ԭΪMn2+��
��1�������β�����ԭ��ɱ�ʾΪ3ClO��![]() 2Cl��+ClO3-���÷�Ӧ��ƽ�ⳣ������ʽΪ ��
2Cl��+ClO3-���÷�Ӧ��ƽ�ⳣ������ʽΪ ��
��2���ⶨ�����ˮ��ClO3-������ʵ�����£�
����1����ȡ��ˮ��ƷV mL������pH��9~10����ϡ����500 mL��
����2��ȡ10.00 mLϡ�ͺ����Һ���μ�5%��˫��ˮ�������ٲ������ݡ�
����3�����뱥��NaHCO3��Һ20 mL����С�
����4����ȴ��������ϡ�����ữ��
����5������a mol��L-1FeSO4��ҺV1 mL��������������ͼ��ʾװ����С�

����6����ȴ����c mol��L-1KMnO4����Һ�ζ����յ㣬����KMnO4����ҺV2mL��
��ϡ��ʱ�õ��IJ����������ձ�����ͷ�ιܡ� ��
������2��˫��ˮ��ȥ��ˮ�в���ClO�������ӷ���ʽΪ ����ԭ������Na2SO3��ԭ��Ϊ ��
���벽��5��ͨN2Ŀ����ͬ��ʵ���� ����д����ţ���
������ˮ������ClO3-��Ũ��Ϊ mol��L-1���ú���ĸ�Ĵ���ʽ��ʾ����
��Ϊ���ʵ�����ľ�ȷ�ȣ����貹���ʵ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ڱ��У������ҹ���18�����С���1����(��������)Ϊ�����Ԫ�أ�ϡ������Ԫ���ǵ�18���С�����˵����ȷ����(����)
A.��Ԫ��λ�ڵ�3����
B.����Ԫ�������ڱ���ռ10������
C.��18��������Ԫ�ص���������8������
D.��16����Ԫ�ض��Ƿǽ���Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MnO2��FeSO4��Һ�������ַ�Ӧ����ˣ�����Һ������60�����ټ���Na2CO3��Һ�����տ��Ƶü�ʽ̼����[aMnCO3��bMn(OH)2��cH2O]��
��1���÷���м�����ᷴӦ�Ʊ�FeSO4��Һʱ��������м�������ֵ�Ըߣ�ԭ���� ����Ӧǰ�轫����м����Na2CO3��Һ���ݣ���Ŀ���� ��
��2��Ϊ�ⶨ��ʽ̼������ɣ�ȡ7.390 g��Ʒ�������ᣬ����CO2 224.0 mL����״�����������500 mL��Һ��ȷ��ȡ10.00 mL����Һ����0.0500 mol��L-1 EDTA����ѧʽNa2H2Y������Һ�ζ����е�Mn2+��ԭ��ΪMn2+ +H2Y2��=MnY2��+2H+�������յ�ʱ����EDTA����Һ28.00 mL��ͨ������ȷ������Ʒ�Ļ�ѧʽ����д��������̣�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������밲ȫ�йص�˵����ȷ����
A. �������������Ԫ�أ�����Ҫ��Ը����ߵ����ʳ��
B. ��ȼ�Լ���ǿ�������Լ��ֿ����ò�Զ���Դ
C. ŨH2SO4����Ƥ���ϣ�������̼����ϡ��Һϴ��
D. ��������Ũ��Һ�������У�Ӧ�����ô���ˮ��ϴ������ϡ�����ϴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯�У������ڻ�ѧ�仯����( )
A. ú������ B. ʯ�ͷ��� C. ʯ���ѽ� D. ú�ĸ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com