
| A. | 钢铁发生电化腐蚀的正极反应式:Fe-2e-═Fe2+ | |
| B. | 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+ | |
| D. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑ |
分析 A.钢铁发生电化学腐蚀时,负极上Fe失电子发生氧化反应;
B.氢氧燃料电池中,负极上氢气失电子发生氧化反应,正极上氧气得电子发生还原反应;
C.精炼粗铜时,粗铜连接电源正极、纯铜连接电源负极;
D.电解饱和食盐水时,阳极上氯离子放电、阴极上氢离子放电.
解答 解:A.钢铁发生电化学腐蚀时,负极上Fe失电子发生氧化反应,所以负极反应式为Fe-2e-═Fe2+,故A错误;
B.氢氧燃料电池中,负极上氢气失电子发生氧化反应,正极上氧气得电子发生还原反应,如果是氢氧燃料碱性电池,则正极反应式为O2+2H2O+4e-═4OH-,故B错误;
C.精炼粗铜时,粗铜连接电源正极、纯铜连接电源负极,则阳极上电极反应式为Cu-2e-═Cu2+、阴极电极发生有为Cu2++2e-═Cu,故C错误;
D.电解饱和食盐水时,阳极上氯离子放电、阴极上氢离子放电,则阳极、阴极反应式分别为2Cl--2e-=Cl2↑、2H++2e-=H2↑,故D正确;
故选D.
点评 本题考查电极反应式的书写,为高频考点,明确各个电极上发生的反应是解本题关键,电解时知道离子放电顺序,注意B中电解质溶液酸碱性不同其电极反应式不同,题目难度不大.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. |  1,4-二甲基丁烷 | B. | 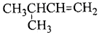 3-甲基丁烯 | C. | 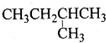 2-甲基丁烷 | D. | 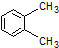 二甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤是工业上获得苯、甲苯、二甲苯等芳香烃的重要来源 | |
| B. | 煤是由多种有机化合物组成的混合物,内含煤焦油等成分 | |
| C. | 煤除了含有C、H元素外,还含有少量的N、S、O等元素 | |
| D. | 煤等化石燃料的储量有限,节能和开发新能源是人类实现可持续发展的关键之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气能在氧气中燃烧,说明氧气具有可燃性 | |
| B. | 水通电分解时生成氢气和氧气,说明水是由氢气和氧气组成 | |
| C. | 将石蕊试液滴入稀硫酸中溶液显红色,说明石蕊试液能使酸变红 | |
| D. | 通过在显微镜下观察木炭,得知木炭具有疏松多孔的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和水反应:Na+H2O=Na++OH-+H2↑ | |
| B. | 二氧化硅和氢氧化钠溶液反应:SiO2+2OH-=SiO32-+H2O | |
| C. | 碳酸氢钡和稀硝酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | 工业上电解饱和食盐水的反应:2Na++2Cl-$\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
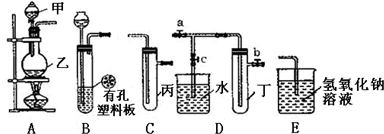
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com