
 ��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ•mol-1��-283.0kJ•mol-1��-726.5kJ��•mol-1����ע��ȼ���ȣ�1molȼ����ȫȼ�����ų���������Ϊ��ȼ�ϵ�ȼ���ȣ�����ش��������⣺
��ѧ������̫���ֽܷ�ˮ���ɵ������ڴ����������������̼��Ӧ���ɼ״�����������ֱ���Լ״�Ϊȼ�ϵ�ȼ�ϵ�أ���֪H2��g����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-285.8kJ•mol-1��-283.0kJ•mol-1��-726.5kJ��•mol-1����ע��ȼ���ȣ�1molȼ����ȫȼ�����ų���������Ϊ��ȼ�ϵ�ȼ���ȣ�����ش��������⣺���� ��1������������ȼ���ȿ�֪ˮ�ֽ����յ�������Ȼ�����û�ѧ�������뷴Ӧ�ȵĹ�ϵ�����㣻
��2������CH3OH��ȼ��������д�ȷ���ʽ�����Ǽ״���ȫȼ�յ��Ȼ�ѧ����ʽ��
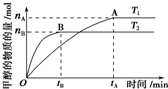
��3������ͼ���м״��ı仯�����㷴Ӧ���ʣ�������ͼ����ʱ�������ʵĹ�ϵ������T1��T2��������Ӱ��ƽ����������������
��4�����ݻ�ѧƽ������η�����ƽ��ʱ�����ʵ����ʵ����������÷�Ӧǰ����������ʵ���֮�ȵ���ѹǿ֮�������
��5���״�ȼ�ϵ�أ��״��ڸ���ʧ���ӷ���������Ӧ�������������ŵ磬��������������ˮ��
��6��CH3OH��l����ȼ����Ϊ-726.5kJ��������ĵ�����ȼ�շų���ȼ�ϵıȼ�Ϊȼ�ϵ�ص�����Ч�ʣ�
��� �⣺��1����H2��g����ȼ���ȡ�HΪ-285.8kJ•mol-1֪��1molH2��g����ȫȼ������1molH2O��l���ų�����285.8kJ��
���ֽ�1mol H2O��l��Ϊ1mol H2��g�����ĵ�����Ϊ285.8kJ����ֽ�10mol H2O��l�����ĵ�����Ϊ285.8kJ��10=2858kJ��
�ʴ�Ϊ��2858��
��2��CH3OH��l����ȼ���ȡ�HΪ-726.5kJ•mol-1����CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2 H2O��l����H=-726.5kJ•mol-1���ʴ�Ϊ��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2 H2O��l����H=-726.5kJ•mol-1��
��3���������ͼ�������֪��T2�ȴﵽƽ����T2��T1�����¶����߷�Ӧ���������֪T2�ķ�Ӧ���ʴ���T1�����¶ȸ�ʱƽ��״̬CH3OH�����ʵ����٣���˵�����淴ӦCO2+3H2?CH3OH+H2O���淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ����T1ʱ��ƽ�ⳣ����T2ʱ�Ĵ�
A��v��CH3OH��=$\frac{\frac{{n}_{A}}{2L}}{{t}_{A}}$=$\frac{{n}_{A}}{2{t}_{A}}$mol/L•min����A����
B������ӦΪ���ȷ�Ӧ���������ͼ�������֪��T2�ȴﵽƽ����T2��T1�������¶ȣ�ƽ�����淴Ӧ�����ƶ����÷�Ӧ��T1ʱ��ƽ�ⳣ����T2ʱ�Ĵ�B����
C������ͼ�����T2�ȴﵽƽ����T2��T1�����¶����߷�Ӧ���������֪T2�ķ�Ӧ���ʴ���T1�����¶ȸ�ʱƽ��״̬CH3OH�����ʵ����٣���˵�����淴ӦCO2+3H2?CH3OH+H2O���淴Ӧ�����ƶ���������ӦΪ���ȷ�Ӧ����C��ȷ��
D������A��ķ�Ӧ��ϵ��T1�䵽T2�������¶ȣ�ƽ�����淴Ӧ�����ƶ����ﵽƽ��ʱ���������ʵ������״������ʵ�����С����$\frac{n��{H}_{2}��}{n��C{H}_{3}OH��}$����D��ȷ��
�ʴ�Ϊ��CD��
��4���ɻ�ѧƽ�������ģʽ�������֪��
CO2 ��g��+3H2��g��=CH3OH��g��+H2O��g��
��ʼ 1 3 0 0
�仯 a 3a a a
ƽ�� 1-a 3-3a a a
������ͬ�����������ѹǿ֮�ȵ������ʵ���֮�ȣ�
�������ڵ�ѹǿ����ʼѹǿ֮��Ϊ=��1-a+3-3a+a+a������1+3��=��2-a����2��
�ʴ�Ϊ����2-a����2��
��5���״�ȼ�ϵ�أ��״��ڸ���ʧ���ӷ���������Ӧ�������������ŵ磬��������������ˮ�������缫��ӦʽΪ��O2+4e-+4H+�T2H2O���ܵĵ缫��ӦʽΪ��2CH3OH+3O2=2CO2+4H2O���ʴ�Ϊ��O2+4e-+4H+=2H2O��2CH3OH+3O2=2CO2+4H2O��
��6����ȼ�ϵ�ص�����Ч��=702.1kJ��726.5kJ��100%=96.6%���ʴ�Ϊ��96.6%��
���� ���⿼���˷�Ӧ�ȵļ��㡢�Ȼ�ѧ����ʽ����д��˹���ɵ�Ӧ�ã�ԭ��ص缫��Ӧ��д��������Ŀ�Ѷ��еȣ�


 ѧ���쳵�����ּ��������ҵ�½����������ϵ�д�
ѧ���쳵�����ּ��������ҵ�½����������ϵ�д� �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��pH=12����Һ�У�K+��Cl-��HCO3-��Na+ | |
| B�� | ��[H+]=10-12 mol•L-1����Һ��K+��Ba2+��Cl-��Br- | |
| C�� | ʹ��̪��Һ������Һ��Na+��Cl-��SO42-��Fe3+ | |
| D�� | ʹʯ����Һ������Һ��K+��MnO4-��I-��H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ڷ�Ӧ��ʧȥ���ӣ��������������� | |
| B�� | �û���Ӧһ������������ԭ��Ӧ | |
| C�� | ������ԭ��Ӧ�ı�����Ԫ�ػ��ϼ۵����� | |
| D�� | ������Ӧʱ�����Ӳ�������ͬ��Ԫ�ؼ�ת�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
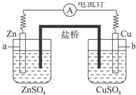
| A�� | �������Ų�Ӱ���ԭ��صĹ��� | |
| B�� | ��ع���ʱ��������K+����Zn�缫һ���ƶ� | |
| C�� | ��ع���ʱ��������Cl-����Zn�缫һ���ƶ� | |
| D�� | ��ع���ʱ�������еĵ�����Cu�缫��Zn�缫�ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �ڢ� | C�� | �ڢ� | D�� | �ڢۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����Һ��Na+��K+��[Fe��CN��6]3-��I-���Դ������� | |
| B�� | �μ�ϡ���ᣬ����������� | |
| C�� | ͨ��H2S���壬������Ӧ�����ӷ���ʽΪFe2++S2-�TFeS�� | |
| D�� | 50mL����Һ�����Zn��ַ�Ӧ������0.56gFe |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com