
【题目】NH3可用于生产硝酸和尿素。
(1)生产硝酸:
①NH3催化氧化是工业制硝酸的第一步反应,其化学方程式是______________。
②除此之外,相同条件下还可能发生以下副反应:
4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) ![]()
4NH3(g)+3O2(g)=2N2O(g)+6H2O(g) ![]()
两个副反应在理论上趋势均很大,但实际生产中影响并不大,原因是______________。
(2)生产尿素:
①尿素的合成分两步进行;
a.2NH3(g)+CO2(g)![]() NH2COONH4(l)
NH2COONH4(l) ![]()
b.NH2COONH4(l)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) ![]()
则总反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)的
CO(NH2)2(l)+H2O(l)的![]() =_____________。
=_____________。
②下图为n(NH3):n(CO2)=4:1时,温度对CO2的转化率的影响。解释温度升高CO2的平衡转化率增大的原因:______________。

③测定尿素样品含氮量的方法如下:取a g尿素样品,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则尿素样品中氮元素的质量分数是______________。
【答案】4NH3+5O2![]() 4NO+6H2O 使用催化剂提高氨的催化反应的选择性
4NO+6H2O 使用催化剂提高氨的催化反应的选择性 ![]() 升高温度,反应b正向移动
升高温度,反应b正向移动 ![]()
【解析】
(1)①工业制硝酸是氨的催化氧化,第一步为氨气催化氧化为NO和水;
②催化剂具有高效性、唯一性和选择性;
(2)①根据盖斯定律可知a+b即可得到总反应式;
②温度升高,平衡向吸热反应方向移动;
③测定溶液中尿素的含量,取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的V1mLc1mol/L的H2SO4溶液吸收完全,产物为(NH4)2SO4,剩余H2SO4用V2mLc2mo/LNaOH溶液恰好中和,则参与吸收氨气的硫酸的物质的量为(c1V1![]() c2V2)×103mol,吸收氨气的反应为2NH3+H2SO4═(NH4)2SO4,根据N元素守恒予以解答。
c2V2)×103mol,吸收氨气的反应为2NH3+H2SO4═(NH4)2SO4,根据N元素守恒予以解答。
(1)①工业制硝酸是氨的催化氧化,第一步为氨气催化氧化为NO和水,发生反应的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
②结合催化剂的选择性,使用催化剂提高氨的催化反应的选择性,则两个副反应在理论上趋势均很大,但实际生产中影响并不大;
(2)①已知:a.2NH3(g)+CO2(g)![]() NH2COONH4(l)△H=-117kJ/mol;b.NH2COONH4(l)
NH2COONH4(l)△H=-117kJ/mol;b.NH2COONH4(l)![]() CO(NH2)2(l)+H2O(l)△H=+15kJ/mol,根据盖斯定律,a+b得总反应式为2NH3(g)+CO2(g)
CO(NH2)2(l)+H2O(l)△H=+15kJ/mol,根据盖斯定律,a+b得总反应式为2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)△H=-102kJ/mol;
CO(NH2)2(l)+H2O(l)△H=-102kJ/mol;
②当n(NH3):n(CO2)=4:1时,温度升高,CO2的平衡转化率增大是因为反应b温度升高时,平衡向正方向移动,而对反应a减小生成物,同样促进平衡正向移动;
③取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的V1mLc1mol/L的H2SO4溶液吸收完全,产物为(NH4)2SO4,发生的反应为2NH3+H2SO4═(NH4)2SO4,剩余H2SO4用V2mLc2mo/LNaOH溶液恰好中和,则参与吸收氨气的硫酸的物质的量为(c1V1![]() c2V2)×103mol,根据反应关系,氨气的物质的量为n(NH3)=2×(c1V1
c2V2)×103mol,根据反应关系,氨气的物质的量为n(NH3)=2×(c1V1![]() c2V2)×103molmol=(2c1V1-c2V2)×10-3mol,根据N元素守恒,尿素中氮元素的物质的量为n(N)=n(NH3)=(2c1V1-c2V2)×10-3mol,则尿素中氮元素的质量分数是w=
c2V2)×103molmol=(2c1V1-c2V2)×10-3mol,根据N元素守恒,尿素中氮元素的物质的量为n(N)=n(NH3)=(2c1V1-c2V2)×10-3mol,则尿素中氮元素的质量分数是w=![]() ×100%=
×100%=![]() ×100%。
×100%。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】实验室经常利用KMnO4来检验产物或验证性质,图示为部分装置图,下列说法不正确的是

A.若X为NaOH溶液时,则KMnO4可用于溴乙烷发生消去反应的产物检验
B.若X为NaOH溶液时,则KMnO4可用于乙醇发生消去反应的产物检验
C.若X为CuSO4溶液时,则KMnO4可用于实验室制取乙炔时验证其性质
D.若X为溴水,则KMnO4可用于乙醛发生还原反应的产物检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为监测空气中汞蒸气是否超标,通过悬挂涂有CuI(白色)的滤纸,根据滤纸是否变色(亮黄色至暗红色)及变色所需时间来判断空气中的汞含量。发生的化学反应为:4CuI+Hg=Cu2HgI4+2Cu。下列说法不正确的是
A.上述反应属于置换反应
B.Cu2HgI4既是氧化产物又是还原产物
C.该反应中的氧化剂与还原剂的物质的量之比为2:1
D.当有1mol CuI参与反应时,转移电子的物质的量为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产物硫酸亚铁[含Ti(SO4)2及少量Fe2(SO4)3]制取铁红的工艺流程如图所示。

(1)加热近沸条件下“精制”硫酸亚铁的过程中,Ti4+会与水作用生成偏钛酸(H2TiO3)沉淀,此反应的离子方程式为__________,加入铁屑的作用是__________(用离子方程式表示)。
(2)“氧化”工序中发生反应的化学方程式有________。
(3)滤渣2能溶于酸和浓强碱,不溶于水。洗涤滤渣2最好选用的试剂是______(填写序号)。
a 稀硫酸 b 稀盐酸 c 浓NaOH溶液 d 蒸馏水
(4)副产品M的化学式为_________,由滤液得到M的操作为蒸发浓缩、_____、_____、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料。由A制备聚合物C和![]() 的合成路线(部分反应条件略去)如图所示:
的合成路线(部分反应条件略去)如图所示:

已知:①![]() +
+![]() Δ
Δ![]() ;②R-C≡N
;②R-C≡N![]() R-COOH。
R-COOH。
回答下列问题:
(1)A的名称是________
(2)C的结构简式为_______
(3)![]() 发生缩聚反应的有机产物的结构简式为________。
发生缩聚反应的有机产物的结构简式为________。
(4)E→F的化学方程式为_______.
(5)B的同分异构体中,与B具有相同的官能团且能发生银镜反应的共有________种;其中核磁共振氢谱为3组峰,且峰面积之比为6:1:1的是________(写结构简式)。
(6)写出用苯乙烯![]() 为原料制备化合物
为原料制备化合物![]() 的合成线路,其他无机试剂任选______。
的合成线路,其他无机试剂任选______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:断裂1 mol C=C键、1 mol C-H键、1 mol H-H键、1 mol C-C键吸收的能量分别为615 kJ、413.5 kJ、436 kJ、347 kJ;键能是指气态基态原子形成1 mol化学键释放的最低能量,单位为kJ·mol-1,乙烯转化为乙烷的过程如图所示,下列说法正确的是

A.C=C键的键能小于C-C键的键能
B.由乙生成1 mol丙时放出的能量为2001 kJ
C.CH2=CH2(g)、H2(g)反应生成1 mol CH3CH3(g)时放出的能量为123 kJ
D.甲、乙、丙中物质含有的总能量大小关系为乙>丙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学分别设计实验,测定CO2与Na2O2反应后的残留物(成分为Na2O2、Na2CO3及少量不溶性杂质)中Na2O2的质量分数。
(1)甲同学设计的实验流程如下:

①试样溶解过程中发生反应的化学方程式为_______。
②实验中用12 molL-1盐酸配制2molL-1盐酸500mL,配制过程中用到的仪器有烧杯、玻璃棒、_____、______、_______,定容时俯视刻度线会使所配溶液浓度_____(填“偏高”“偏低”或“无影响”)。
③称取试样5.12 g,得滤渣0.10g,烘干得固体5.85g,则试样中Na2O2的质量分数为___________%(保留1位小数)。
(2)乙同学利用如图所示装置进行实验。

①实验中应选取的试剂是_______________。
a 稀盐酸 b 二氧化锰 c 蒸馏水 d 碳酸钙
②装置的连接顺序应是_______________________(填各接口的字母,连接胶管略)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有大量Na+、C1-及少量Ca2+、Mg2+、SO42-,用电渗析法对该海水样品进行淡化处理,如右图所示。下列说法正确的是
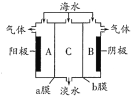
A. b膜是阳离子交换膜
B. A极室产生气泡并伴有少量沉淀生成
C. 淡化工作完成后A、B、C三室中pH大小为pHA<pHB<pHC
D. B极室产生的气体可使湿润的KI淀粉试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用如图所示装置制取氯气,下列说法不正确的是( )

A.该装置图中至少存在两处明显错误
B.该实验中收集氯气的方法不正确
C.为了防止氯气污染空气,必须进行尾气处理
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com