
【题目】城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它由煤炭和水蒸气反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式_________________________。
(2)液化石油气的主要成分是丙烷,已知丙烷、CO以及氢气燃烧的热化学方程式分别为:
C3H8(g) +5O2(g) == 3CO2(g) + 4H2O(l) △H= –2220.0 kJ·![]()
CO(g) +1/2O2(g) == CO2(g) △H= –282.6kJ·![]()
2H2(g)+O2(g) == 2H2O(l) △H= –571.6 kJ·![]()
试比较同质量的H2和C3H8燃烧,产生的热量比值约为_______。(计算结果保留小数点后一位数字)
(3)氢能源是21世纪极具开发前景的新能源之一,它既是绿色能源,又可循环使用。
请在下图的两个空框中填上循环过程中的反应物和生成物,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。

__________________________、 ___________________________
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】研究表明,化学反应的能量变化与反应物和生成物的键能有关,键能可以简单的理解为断开1mol化学键时所吸收的能量或生成1mol化学键时所释放的能量。下表是部分化学键的键能数据:
化学键 | P-P | P-O | O=O | P=O |
键能/kJ·mol-1 | 197 | X | 499 | 434 |
已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),1mol白磷完全燃烧放出热量2378.0kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物P4O10结构如图所示,则上表中X约为

A. 410B. 335C. 360D. 188
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】要使氯化铝溶液中的Al3+完全转化为Al(OH)3沉淀,应选用的最佳试剂是
A. NaOH溶液 B. 稀盐酸 C. 氨水 D. AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理的利用吸收工业产生的废气CO2、NO2、SO2 等可以减少污染,变废为宝。
(1)用CO2可以生产燃料甲醇。
已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1;
则表示CH3OH(g)燃烧的热化学方程式为:_______________________。
(2)光气(COCl2)是重要化工原料,常用于聚酯类材料的生产,工业通过Cl2(g)+CO(g)COCl2(g)△H < 0制备。图为实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:

①0~6min内,反应的平均速率v(Cl2)=___________;
②该反应第一次达平衡时的平衡常数为___________,10min改变的条件是_____________。
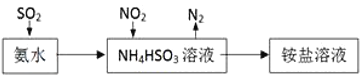
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:NO2被吸收的离子方程式是________________________________。
(4)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),于1 L的恒容密闭容器中进行反应。下列能说明该反应已经达到平衡状态的是________(填字母代号)。
N2(g)+2CO2(g),于1 L的恒容密闭容器中进行反应。下列能说明该反应已经达到平衡状态的是________(填字母代号)。
A.c(CO)=c(CO2) B.容器中混合气体的密度不变
C.2v(N2)正=v(NO)逆 D.容器中混合气体的平均摩尔质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】云阳龙缸云端廊桥曾被詟为“世界第一悬挑玻璃景观廊桥”,所用钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制.
(1)基态硫原子价层电子的轨道表达式(电子排布图)为____________,基态镍原子中核外电子占据最高能层的符号为_____________.
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___________晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为___________,写出与配体互为等电子体的阴离子__________________________________________________________(任写一种).
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式)______,理由是_______________________________________________________________.
(4)H2S的键角__________(填“大于”“小于””等于”)H2O的键角,请从电负性的角度说明理由___________________________________________________.
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为_________g/cm3(只列出计算式).

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com