
【题目】在常温下,体积相同、pH均为3的醋酸和硫酸的说法正确的是( )
A.分别加入足量锌片,两种溶液生成H2的体积相同
B.分别加水稀释100倍后,两种溶液的pH仍相同
C.醋酸中的c(CH3COO﹣)和硫酸中的c(SO ![]() )相等
)相等
D.两种溶液中,由水电离出的氢离子浓度均为1×10﹣11 mol?L﹣1
【答案】D
【解析】解:A、硫酸是强电解质,完全电离,醋酸是弱电解质,溶液中主要以醋酸分子存在,与足量的锌反应,体积相同、pH相同的醋酸提供的氢离子远远大于硫酸,锌与醋酸反应产生的氢气原大于与硫酸反应生成的氢气,故A错误; B、醋酸是弱电解质,加水稀释促进电离,加水稀释100倍后,硫酸的pH=5,而醋酸的pH小于5,所以分别加水稀释100倍后,两种溶液的pH不相同,故B错误;
C、根据电荷可知,醋酸溶液中c(H+)=c(CH3COO﹣)=1×10﹣3mol/L,硫酸溶液中c(H+)=2c(SO42﹣)=1×10﹣3mol/L,故c(SO42﹣)=5×10﹣4mol/L,故C错误;
D、pH均为3的醋酸和硫酸,溶液中氢离子浓度均为1×10﹣3mol/L,溶液中氢氧根浓度均为c(OH﹣)= ![]() =1×10﹣11mol/L,溶液中水电离出的氢离子浓度等于溶液中氢氧根离子的浓度,故两种溶液中,由水电离出的氢离子浓度均为1×10﹣11molL﹣1 , 故D正确;
=1×10﹣11mol/L,溶液中水电离出的氢离子浓度等于溶液中氢氧根离子的浓度,故两种溶液中,由水电离出的氢离子浓度均为1×10﹣11molL﹣1 , 故D正确;
故选D.
【考点精析】解答此题的关键在于理解弱电解质在水溶液中的电离平衡的相关知识,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
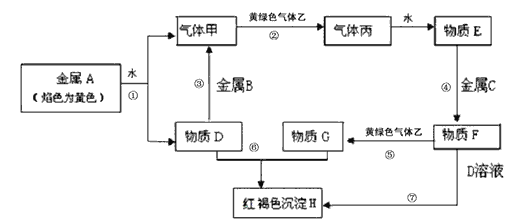
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A:_____ B:_____ F:______ 丙:______
(2)说出黄绿色气体乙的一种用途:____________________。
(3)若除去F溶液中含有的少量G,需加入______,实验室检验G中所含的金属离子时,常在G的溶液中加入_______________溶液。
(4)反应①的离子方程式为_______________________________________。
(5)反应⑦涉及的化学方程式有____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中,Cl-、Br-、I-的物质的量分别为2mol、3mol、4mol;若通入一定量的氯气,使得溶液中Br-物质的量变为1mol,则通入氯气的物质的量为
A.1molB.2molC.3molD.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质只含C,H,O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). 
(1)该物质的结构简式为
(2)该物质中所含官能团的名称为 .
(3)下列物质中,与该产品互为同系物的是(填序号) , 互为同分异构体的是 . ①CH3CH═CHCOOH ②CH2═CHCOOCH3
③CH3CH2CH═CHCOOH ④CH3CH(CH3)COOH.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.请根据装置回答下列问题: 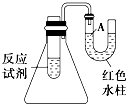
(1)将铝片加入小试管内,然后注入足量稀盐酸,有关反应的离子方程式是 , 试管中观察到的现象是 .
(2)U形导管中液面A(填“上升”或“下降”),原因是 , 说明此反应是(填“吸热”或“放热”)反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2经一系列过程可以得到HNO3和NH4HCO3,如下图所示。

(1)过程 ______ 属于“氮的固定”。
(2)过程Ⅱ,NH3和O2在催化剂作用下反应,其化学方程式是________。
(3)过程Ⅳ,为使NO2尽可能多地被水吸收,需不断的向反应器中通入________。
(4)NH4HCO3常用作铵态氮肥,但不宜在碱性较强的土壤中施用,原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中学学习小组模拟工业烟气脱硫(SO2)。
(1)甲组采用如下装置脱硫(部分装置略)。

① CaO脱硫后的产物是_________。
② b中品红很快褪色,说明脱硫效果不好。下列措施能提高脱硫效果的是_____。
ⅰ. 加快SO2气体流速
ⅱ. 将堆集在一起的CaO平铺在整个玻璃管
ⅲ. 加热a,脱硫效果可能会更好
③ 小组拟通过CaO的增重评价其脱硫能力。需要测量的数据是_______。
(2)乙组选用AgNO3溶液脱除SO2 。

现象:通入SO2,立即生成大量白色沉淀A。
对白色沉淀A的成分进行探究,提出假设:
假设1:发生了氧化还原反应,依据是AgNO3溶液中含有O2、![]() 等具有氧化性的粒子,沉淀A主要是Ag2SO4(微溶)。
等具有氧化性的粒子,沉淀A主要是Ag2SO4(微溶)。
假设2:发生了复分解反应,依据是SO2与水生成酸,能与AgNO3溶液发生复分解反应。
实验探究:
① 取沉淀A,加入蒸馏水,静置。取上层清液滴加Ba(NO3)2溶液,无明显变化。
② 取______,加入蒸馏水,静置。取上层清液滴加Ba(NO3)2溶液,产生沉淀。
实验证明“假设1”不成立。
③ 为进一步确认“假设2”,向A中加入浓HNO3,立即产生红棕色气体。加入浓硝酸的目的是________;经确认,反应后混合液存在SO![]() 。
。
实验证明“假设2”成立。
④ 产生沉淀A的化学方程式是_________。AgNO3溶液具有良好的脱硫能力,但因其价格高,未能大规模使用。
(3)丙组用NaClO脱除SO2,用1 L 0.1 mol/L 的NaClO溶液最多可以吸收标准状况下的SO2_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示.下列有关说法正确的是( ) 
A.实验①中溶液呈蓝色,试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B.实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C.实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4═4CuSO4+2NO↑+4H2O
D.由上述实验可得出结论:Cu在常温下既可以和稀硝酸反应,也可以和稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素M、N、X、Y、Z的原子序数依次增大,它们组成的单质或化合物存在如下转化关系。甲、丁为二元化合物(两种元素形成的化合物),乙、戊为单质,丙、己为三元化合物。已知25℃时,0.1mol/L的甲、丙两溶液的pH分别为l、13 ,丁、己两溶液混合时产生白色沉淀。下列推断正确的是( )
A.M分别与N、X、Z形成的简单化合物中,M与N形成的化合物熔点最高
B.原子半径:Z>Y>X>M>N
C.X、Y、Z的最高价氧化物对应的水化物能相互反应
D.Z的阴离子结合质子的能力比N的阴离子强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com