
CO2��CH4��������Ҫ���������壬ͨ��CH4��CO2��Ӧ�������ֵ��ѧƷ��Ŀǰ���о�Ŀ�ꡣ
��1��250��ʱ�������Ͻ�Ϊ��������4 L������ͨ��6 mol CO2��6 mol CH4���������·�Ӧ��CO2 (g)��CH4(g) 2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
2CO(g)��2H2(g)��ƽ����ϵ�и��������������±���
| ���� | CH4 | CO2 | CO | H2 |
| ������� | 0.1 | 0.1 | 0.4 | 0.4 |
�ٴ��¶��¸÷�Ӧ��ƽ�ⳣ��K=__________
����֪��CH4(g)��2O2(g)��CO2(g)��2H2O(g) ��H=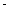 890.3 kJ·mol��1
890.3 kJ·mol��1
CO(g)��H2O (g)��CO2(g)��H2 (g) ��H=+2.8 kJ·mol��1
2CO(g)��O2(g)��2CO2(g) ��H=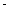 566.0 kJ·mol��1
566.0 kJ·mol��1
��ӦCO2(g)��CH4(g) 2CO(g)��2H2(g) �ġ�H=________________
2CO(g)��2H2(g) �ġ�H=________________
��2���Զ������ѱ��渲��Cu2Al2O4Ϊ���������Խ�CO2��CH4ֱ��ת�������ᡣ
���ڲ�ͬ�¶��´����Ĵ�Ч���������������������ͼ��ʾ��250��300��ʱ���¶����߶�������������ʽ��͵�ԭ����_____________________
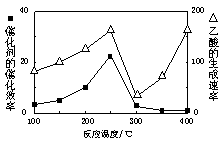
��Ϊ����߸÷�Ӧ��CH4��ת���ʣ����Բ�ȡ�Ĵ�ʩ��________________________
�۽�Cu2Al2O4�ܽ���ϡ�����е����ӷ���ʽΪ___________________________
��3��Li2O��Na2O��MgO��������CO2�������Ѱ������CO2���������ʣ����н����������______
a.���ڼ�����������Ѱ��
b.���ڢ�A����A��Ԫ���γɵ���������Ѱ��
c.���ھ���ǿ�����Ե�������Ѱ��
��Li2O����CO2�������ںϳ�Li4SiO4��Li4SiO4�������ա��ͷ�CO2��ԭ���ǣ���500�棬CO2��Li4SiO4�Ӵ�������Li2CO3��ƽ��������700�棬��Ӧ������У��ų�CO2��Li4SiO4������˵����ԭ���Ļ�ѧ����ʽ��___________________________
��4�����÷�ӦA�ɽ��ͷŵ�CO2ת��Ϊ���й�ҵ���ü�ֵ�IJ�Ʒ��
��ӦA��
���µ�⼼���ܸ�Чʵ�֣�3���з�ӦA������ԭ��ʾ��ͼ���£�

CO2�ڵ缫a�ŵ�ķ�Ӧʽ��_____________________________________________
��֪ʶ�㡿��Ӧ�ȵļ��㡢��ѧƽ�ⳣ���ĺ��塢��ѧƽ���Ӱ�����ء����ԭ��
���𰸽������Ţ�64 ��+247.3 kJ·mol��1
�Ƣ��¶ȳ���250��ʱ�������Ĵ�Ч�ʽ���
������Ӧѹǿ������CO2��Ũ��
��3Cu2Al2O4+32H++2NO3��=6Cu2++ 6Al3++2NO��+16 H2O
��3����ab ��1�֣� ��CO2 + Li4SiO4  Li2CO3 + Li2SiO3
Li2CO3 + Li2SiO3
��4��CO2 + 2e- == CO+O2-
��������1���� CO2��g��+CH4��g��⇌2CO��g��+2H2��g��
��ʼ��mol�� 6 6 0 0
��Ӧ��mol�� X X 2X 2X
ƽ�⣨mol�� 6-X 6-X 2X 2X
��CH4���������Ϊ0.1����(6-x)/(12+2x)=0.1�����X=4������K=(22��22)/(0.5��0.5)=64
��CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-890.3kJ•mol-1 ��
CO��g��+H2O ��g��=CO2��g��+H2 ��g����H=2.8kJ•mol-1 ��
2CO��g��+O2��g��=2CO2��g����H=-566.0kJ•mol-1 ��
���ݸ�˹���ɣ��ɢ�+�ڡ�2-�ۡ�2��
CO2��g��+CH4��g��⇌2CO��g��+2H2��g����H=(-890.3+2.8��2+566.0��2) kJ•mol-1=+247.3 kJ•mol-1��
��2�����¶ȳ���250��ʱ�������Ĵ�Ч�ʽ��ͣ������¶����߶�������������ʽ��ͣ�
������Ӧѹǿ������CO2��Ũ�ȣ�ƽ�������ƶ�����Ӧ��ת��������
��Cu2Al2O4������������ʽ��Cu2O•Al2O3�����ᷴӦ�������ӷ���ʽ��
3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO��+16H2O��
��3����a��Li2O��Na2O��MgO�����ڼ��������������������������CO2�����ڼ�����������Ѱ������CO2���������ʣ���a��ȷ��
b��Li2O��Na2O��MgO��������CO2���ơ�þ����Ϊ��A����A��Ԫ�أ����Կ��ڢ�A����A��Ԫ���γɵ���������Ѱ������CO2���������ʣ���b��ȷ��
c��Li2O��Na2O��MgO��������CO2�������Ƕ�û��ǿ�����ԣ������ն�����̼��������ԭ�أ���c���� �ʴ�Ϊ��ab��
����500�棬CO2��Li4SiO4�Ӵ�������Li2CO3����Ӧ��ΪCO2��Li4SiO4����������Li2CO3�����������غ��֪���ﻹ��Li2SiO3�����Ի�ѧ����ʽΪCO2 + Li4SiO4  Li2CO3 + Li2SiO3��
Li2CO3 + Li2SiO3��
��4��������̼��a���õ����ӷ�����ԭ��Ӧ����һ����̼ͬʱ���������ӣ���Ӧ�缫��ӦʽΪ��CO2+2e-═CO+O2-��
��˼·�㲦��������Ҫ�������ۺ�����CO2���漰�Ȼ�ѧ��Ӧ���绯ѧ����ѧƽ��Ӱ�����صȣ���Ϊ�ۺϣ���Ŀ�Ѷ��е�


 53������ϵ�д�
53������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ����٤��������ֵ������˵����ȷ����
A�������£�0.2molFe������ˮ������Ӧ�����ɵ�H2������ĿΪ0.3NA
B�������£�1LpH��13��NaOH ��Һ�У���ˮ�����OH��������ĿΪ0.1NA
��Һ�У���ˮ�����OH��������ĿΪ0.1NA
C������ȼ�ϵ����������22.4L����״��������ʱ����·��ͨ���ĵ�����ĿΪ2NA
D��5NH4NO3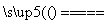 2HNO3��4N2����9H2O��Ӧ�У�����28g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
2HNO3��4N2����9H2O��Ӧ�У�����28g N2ʱ��ת�Ƶĵ�����ĿΪ3.75NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ʽ����ijͬѧ��д��C5H12��ͬ���칹��Ľṹ��ʽ����CH2CH3CH2CH2CH3
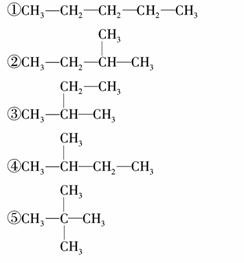
��Щ�ṹ�г����ظ�����(����)
A���٢� B���ܢ�
C���ڢۢ� D�������ظ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���û�ѧ��Ӧԭ��֪ʶ�ش������й�̼��̼�Ļ���������⣺
(1)����β������Ҫ��Ⱦ����NO�Լ�ȼ��ȼ�ղ���ȫ��������CO���������ִ������е���Ҫ������Ⱦ�Ϊ�˼�������β����ɵĴ�����Ⱦ�����ǿ�ʼ̽������NO��CO��һ��������ת��Ϊ����������E��F�ķ���(��֪�÷�Ӧ��H<0). ��2 L�ܱ������м���һ����NO��CO�����¶ȷֱ���T1��T2ʱ����ø�����ƽ��ʱ���ʵ������±���
|
T/�� n/mol | NO | CO | E | F |
| ��ʼ | 0.100 | 0.100 | 0 | 0 |
| T1 | 0.020 | 0.020 | 0.080 | 0.040 |
| T2 | 0.010 | 0.010 | 0.090 | 0.045 |
�������ϱ����ݣ�д��NO��CO��Ӧ�Ļ�ѧ����ʽ .
��������ӦT1��ʱ��ƽ�ⳣ��ΪK1��T2��ʱ��ƽ�ⳣ��ΪK2�����ݱ������ݼ���K1= �����ݱ��������жϣ��¶�T1��T2�Ĺ�ϵ��(�����)__________��
A��T1>T2B��T1<T2 C��T1=T2 D�����Ƚ�
(2)��Ӧ���ɵ�����E�������������������գ�����0.4molE������200mL 3mol/L NaOH��Һ������ȫ���գ���Һ������Ũ���ɴ�С��˳��Ϊ�� .
(3)��֪CH4��H2��CO��ȼ���ȷֱ�Ϊ890.3kJ/mol��285.8 kJ/mol��283.0 kJ/mol����ҵ��������Ȼ��(��Ҫ�ɷ���CH4)��CO2���и��������Ʊ�CO��H2��д���÷�Ӧ���Ȼ�ѧ����ʽ�� .
(4)CO����������ȼ�ϵ�ص�ȼ�ϣ�ij������ȼ�ϵ�ؾ��иߵķ���Ч�ʣ�����ܵ����ӣ��õ���� Li2CO3 �� Na2CO3 �������λ����������ʣ�COΪ����ȼ����������CO2 �Ļ����Ϊ������ȼ�����Ƶ��� 650 ���¹�����ȼ�ϵ�أ�д���为���������缫��Ӧ����ʽ�������� �������� .
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ1���ڽ���п��������һ����ij��Һ��ʪ����ֽ��ͼ2��NaBH4/H2O2ȼ�ϵ�أ������е�˵������ȷ���� �� ��

A��ͼ2����ڷŵ�����У��������ĵ缫��ӦΪ��BH4-�� 8e- + 8OH-��BO2- + 6H2O
B������ϡ�����ʪ��ֽ���õ��߽�a��b���������е��Ӵ�b������ͨ����������a��
C�����������ƺ���ɫʯ��Ļ����Һ��ʪ��ֽ���õ��߽�a��b��������ɿ���Ǧ��оC�㴦������ɫʯ�����ֽ�������˴������缫��ӦΪ��O2 + 2H2O+ 4e- = 4OH-
D������KI-������Һ��ʪ��ֽ��ͬʱ�õ��߽�a��b�ֱ���A��B�缫������������Ǧ��оC�㴦���ֱ���������b�����ӵ���ȼ�ϵ�ص�A��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijͬѧ����ͼ��ʾ��װ�ý��е��ʵ�顣����˵������ȷ����
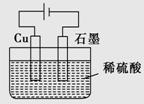
A���������У�ͭ�缫����H2����
B�������ڣ��ܷ�Ӧ����ʽΪCu��H2SO4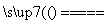 CuSO4��H2��
CuSO4��H2��
C�����һ��ʱ���ʯī�缫����ͭ����
D�������������У���ҺpHֵ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪������KMnO4�����еμ�Ũ���ᣬ��������ɫ���壻����FeCl2��Һ��ͨ������ʵ��ٲ��������壬��Һ���ɫ����ȡ����ʵ������ɵ���Һ���ڵ���KI��ֽ�ϣ���ֽ����ɫ��
�����ж���ȷ����(����)
A������ʵ��֤�������ԣ�MnO4��>Cl2>Fe3��>I2
B������ʵ���У���������������ԭ��Ӧ
C��ʵ������ɵ����岻��ʹʪ��ĵ���KI��ֽ����
D��ʵ���֤��Fe2���������������л�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ݱ�����Ϣ���ж�������������ȷ����(����)
| ��� | ������ | ��ԭ�� | ������Ӧ�� | �������� | ��ԭ���� |
| �� | Cl2 | FeBr2 | / | Cl�� | |
| �� | KMnO4 | H2O2 | H2SO4 | O2 | Mn2�� |
| �� | KClO3 | Ũ���� | / | Cl2 |
A�����Т��鷴Ӧ������һ�ֻ�����Ԫ�ر�����
B��������ǿ���Ƚϣ�KClO3>Fe3��>Cl2>Br2
C�����Т��鷴Ӧ�����ӷ���ʽ��2MnO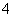 ��3H2O2��6H��===2Mn2����4O2����6H2O
��3H2O2��6H��===2Mn2����4O2����6H2O
D�����Т��鷴Ӧ�Ļ�ԭ������KCl������ת����Ŀ��6e��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ν�Ͻ𣬾��Dz�ͬ�ֽ���(Ҳ����һЩ�ǽ���)������״̬���γɵ�һ���ۺ�������������ֽ������ۡ��е㣬�ж����в����γɺϽ����(����)
| Na | Cu | Al | Fe | |
| �۵�/�� | 97.5 | 1083 | 660 | 1535 |
| �е�/�� | 883 | 2595 | 2200 | 3000 |
A. Cu��Al������������ B. Fe��Cu
C. Fe��Na D. Al��Na
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com