
分析 (1)Cu与H2SO4(浓)在加热条件下反应生成硫酸铜、二氧化硫和水;
(2)根据CuS和H2SO4(浓)反应方程式结合H2SO4(浓)的+6价的S降低到0价的S计算;
(3)实验2是为验证猜测2即证明溶液中含有三价铁离子即可;
(4)根据Cu2SO3•0.5H2O中,Cu+离子在浓硫酸及加热条件下被氧化成Cu2+,SO32-离子与浓硫酸会继续反应判断;
(5)根据信息厂家常在铜表面加一层聚氯乙烯的覆膜分析;
(6)根据乙醇催化氧化成乙醛,Cu作催化剂参与的反应过程分析;
(7)实验a和c是对比实验,通过观察焰色反应的颜色分析绿色到底是铜丝中含有的氯元素还是纯铜引起的,据此分析;
(8)通过实验2中证明了溶液中没有Fe3+.纯净的铜丝与H2SO4(浓)反应,观察到反应后溶液呈蓝色,说明Cu与过量H2SO4(浓)反应溶液呈绿色与铜表面的聚氯乙烯的覆膜有关;
(9)根据氯化铜稀溶液主要以水合铜离子存在,氯合铜离子较少,颜色主要由水合铜离子决定;
(10)根据浓硝酸与纯铜反应除了生成硝酸铜以外还生成了有颜色的二氧化氮气体,而二氧化氮气体溶于水显黄色,与水合铜离子蓝色混合即得绿色溶液,据此分析解答.
解答 解:(1)Cu与H2SO4(浓)在加热条件下反应生成硫酸铜、二氧化硫和水,化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)CuS和H2SO4(浓)反应生成S、CuSO4、H2O,方程式为:3CuS+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3CuSO4+4S+4H2O,则4molH2SO4(浓)参与反应,有mol1H2SO4(浓)的+6价的S降低到0价的S,转移电子数为6e-,所以当有2mol H2SO4参加反应时,反应中转移电子的物质的量为2mol,故答案为:2mol;
(3)实验2是为验证猜测2即证明溶液中含有三价铁离子,所以实验2的方案设计为取反应后的混合溶液2-3ml,加入试管中,向其中加入几滴KSCN溶液,若溶液变血红色,则证明含有Fe3+,故答案为:取反应后的混合溶液2-3ml,加入试管中,向其中加入几滴KSCN溶液,若溶液变血红色,则证明含有Fe3+;
(4)因为Cu2SO3•0.5H2O中,Cu+离子在浓硫酸及加热条件下被氧化成Cu2+,SO32-离子与浓硫酸会继续反应,所以Cu2SO3•0.5H2O在过量浓硫酸及其加热条件下不可能存在,故答案为:Cu+离子在浓硫酸及加热条件下被氧化成Cu2+,SO32-离子与浓硫酸会继续反应;
(5)根据信息厂家常在铜表面加一层聚氯乙烯的覆膜,所以用砂纸打磨去掉表面层的作用是除去聚氯乙烯的覆膜和氧化层,故答案为:除去聚氯乙烯的覆膜和氧化层;
(6)Cu作催化剂,将乙醇催化氧化成乙醛,参与的反应即铜丝先灼烧生成氧化铜,趁热放入乙醇中,氧化铜氧化乙醇生成乙醛,本身被还原为较纯净的铜单质,所以将灼烧铜丝趁热放入乙醇中的目的是制得较纯净的铜,故答案为:制得较纯净的铜;
(7)实验a为正常铜丝灼烧,根据(6)实验c为纯铜灼烧,则a和c是对比实验,通过观察焰色反应的颜色分析绿色到底是铜丝中含有的氯元素还是纯铜引起的,实验a和c的关系和目的是a、c为对比实验,实验a是验证铜丝中是否含有氯元素和含有氯元素的物质利用铜丝完成焰色反应时是否为绿色火焰,实验c是验证纯铜的焰色反应是否为绿色;
故答案为:a、c为对比实验,实验a是验证铜丝中是否含有氯元素和含有氯元素的物质利用铜丝完成焰色反应时是否为绿色火焰,实验c是验证纯铜的焰色反应是否为绿色;
(8)通过实验2中证明了溶液中没有Fe3+.纯净的铜丝与H2SO4(浓)反应,观察到反应后溶液呈蓝色,说明Cu与过量H2SO4(浓)反应溶液呈绿色与铜表面的聚氯乙烯的覆膜有关,则本次实验探究的最终结论是铜与过量的浓硫酸反应时,由于铜表面有聚氯乙烯的覆膜,反应生成了CuCl42-,与水合铜离子混合使溶液呈绿色,故答案为:铜与过量的浓硫酸反应时,由于铜表面有聚氯乙烯的覆膜,反应生成了CuCl42-,与水合铜离子混合使溶液呈绿色;
(9)氯化铜稀溶液,氯离子少,水分子多,则主要以水合铜离子存在,氯合铜离子较少,则颜色主要由水合铜离子决定,所以氯化铜稀溶液一般也呈蓝色,故答案为:氯化铜稀溶液,氯离子少,水分子多,则主要以水合铜离子存在,溶液主要呈现水合铜离子颜色蓝色;
(10)因为稀硝酸与纯铜反应生成硝酸铜所得的溶液呈蓝色即水合铜离子得颜色,浓硝酸与纯铜反应除了生成硝酸铜以外还生成了有颜色的二氧化氮气体,而二氧化氮气体溶于水显黄色,与水合铜离子蓝色混合即得绿色溶液,则证明浓硝酸与纯铜反应所得溶液呈绿色方法为向饱和的蓝色硝酸铜溶液中通入二氧化氮气体,观察溶液颜色变成绿色,说明浓硝酸与纯铜反应所得溶液呈绿色即为溶解的二氧化氮引起的,故答案为:向饱和的蓝色硝酸铜溶液中通入二氧化氮气体,观察溶液颜色变成绿色,说明浓硝酸与纯铜反应所得溶液呈绿色即为溶解的二氧化氮引起的.
点评 本题考查探究Cu与过量H2SO4(浓)反应后溶液呈绿色的原因,为高频考点,把握反应原理、物质的性质、实验原理的作用为解答的关键,侧重分析与实验能力的综合考查,题目难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 既能与酸又能与碱反应的物质一定是两性氧化物或两性氢氧化物 | |
| B. | 往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现沉淀,再继续滴加时,沉淀又会消失 | |
| C. | 胶体区别于其他分散系的本质特征是丁达尔现象 | |
| D. | 某物质溶于水后所得溶液能导电,该物质一定属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液时,容量瓶必须洁净、干燥,不漏水 | |
| B. | 实验室里需要480 mL 2.0 mol/L的氢氧化钠溶液,配制该溶液时先称量氢氧化钠固体38.4 g,然后再按照溶解、冷却、移液、定容、摇匀的步骤进行操作 | |
| C. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液的浓度偏大 | |
| D. | 实验室配制500 mL 0.2 mol/L的硫酸亚铁溶液,其操作是用天平称量27.8 g绿矾,将其放入500 mL容量瓶,加水溶解、稀释、定容、摇匀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某化合物电离时,生成的阳离子有氢离子的一定是酸 | |
| B. | 某化合物电离时,生成的阴离子有氢氧根离子的一定是碱 | |
| C. | 某化合物电离时,只生成了金属阳离子和酸根离子的一定是盐 | |
| D. | NH4Cl是一种盐,电离的电离方程式是:NH4Cl=NH4++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
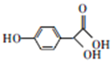
| A. | 用钠可检验M分子中存在羟基 | B. | M能发生酯化、加成、氧化反应 | ||
| C. | M的分子式为C8H8O4 | D. | M的苯环上一硝基代物有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、淀粉、硝化纤维、油脂都属于高分子化合物 | |
| B. | 聚丙烯能使溴水褪色 | |
| C. | 氯丁橡胶在空气中燃烧只生成CO2和H2O | |
| D. | 利用木材作原料制得的纤维是人造纤维 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com