
在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)
 2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是
2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是
A.生成C的速率与C分解的速率相等 B. A、B、C的浓度相等
C.单位时间生成 n mol A,同时生成 3nmol B D. A、B、C的分子数之比为 1∶3∶2
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中,正确的是
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->B2+>C- D.原子最外层电子数:A>C>B
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:填空题
实验室需要0.1 mol/L NaOH溶液450 mL和0.5mol/L硫酸溶液480 mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液需要的是 (填字号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)。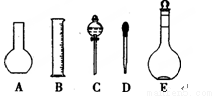
(2)下列操作中,是容量瓶所具备的功能有 。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.配制任意浓度和体积的标准溶液 D.稀释某一浓度的溶液 E.量取一定体积的液体
(3)根据计算用托盘天平称取NaOH的质量为 g。在实验中其他操作均正确,若定容时俯视刻度线,则所得溶液浓度 (填“大于”“等于”或“小于”)0.1 mol/L。若NaOH溶液在转移至容量瓶时,洒落了少许,则需要如何操作: 。
(4)根据计算得知,所需质量分数为98%、密度为l.84 g/cm3的浓硫酸的体积为 ml。如果实验室有10 mL,15 mL,20 mL量筒,应选用 mL的量筒最好。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
(5)下列操作会使配制的NaOH溶液浓度偏低 的是。
A.用滤纸称量NaOH B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线 D.整个配制过程中,容量瓶不振荡
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列对各组离子或物质是否能够大量共存解释正确的是 ( )
A | 常温常压下NH3、O2、H2、CO2 | 不能共存 | NH3为碱性气体,CO2为酸性气体,二者反应生成(NH4)2CO3 |
B | c(OH-)=1×10-13mol/L溶液中,Fe2+、NO3-、SO42-、Na+ | 不能共存 | 发生反应Fe2++NO3-+4H+=3Fe3++NO+2H2O |
C | 溶液中: K+、Cu2+、Cl-、NH3?H2O | 不能共存 | 发生反应Cu2++2OH-=Cu(OH)2 |
D | 溶液中Al3+、Na+、SO42-、HCO3- | 可以共存 | 不能发生反应 |
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:实验题
(10分)乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
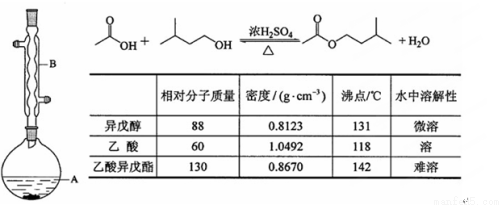
实验步骤:
在A中加入4.4 g的异戊醇、6.0 g的乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是 。
(2)在洗涤操作中,第一次水洗的主要目的是 ,第二次水洗的主要目的是 。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后 (填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是 。
(5)实验中加入少量无水MgSO4的目的是 。
(6)在蒸馏操作中,仪器选择及安装都正确的是 (填标号)。
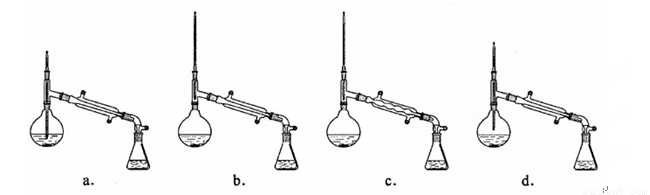 (7)本实验的产率是 (填标号)。
(7)本实验的产率是 (填标号)。
a.30℅ b.40℅ c.60℅ d.90℅
(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏 (填“高”或“低”), 原因是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
在常温常压下,下列四种气态烃各1mol分别在足量氧气中燃烧,消耗氧气最多的是
A. CH4 B. C2H6 C. C3H8 D. C4H10
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是
①11H、21H、31H为三种不同的核素 ②11H、21H、31H互为同位素
③11H、21H、31H互为同素异形体 ④11H、21H、31H同系物 ⑤11H、21H、31H同分异构体
⑥同位素的“同位”指核素的质子数相同,在元素周期表中占相同的位置
⑦互为同位素的原子性质相同
A.①②⑥ B.①②③⑥ C.①②⑥⑦ D.①②③⑥⑦
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
工业生产中物质制备时,通过下列反应原理一步完成获得产物、符合“绿色化学”原则的反应是
A.加成反应 B.分解反应 C.取代反应 D.置换反应
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期中考试化学试卷(解析版) 题型:选择题
下列递变情况中,正确的是
A.Na、Mg、Al原子的最外层电子数依次减少 B.C、N、O的原子半径依次减小
C.Si、P、S元素的最高正化合价依次降低 D.Li、Na、K的金属性依次减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com