
合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为: Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac 。完成下列填空:
[Cu(NH3)3CO]Ac 。完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是 。(选填编号)
a.减压 b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_____________________
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为__________________。通过比较_____________________________可判断氮、磷两种非金属元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是_________________。CS2熔点高于CO2,其原因是 。
【知识点】影响化学反应速率的因素 元素周期表元素周期律 晶体结构G1 E2 E4
【答案解析】(1)bc (2)2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3 (3)C>N>O>H;NH3和PH3的稳定性或最高价含氧酸的酸性;(4)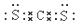 ;CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大。
;CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大。
解析:(1)根据影响反应速率的因素,可以采取的措施是增加反应物的浓度、升高温度,选bc;(2)氨吸收二氧化碳的化学方程式2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3 (3)铜液的组成元素有Cu、N、O、C、H,短周期元素原子半径氢的最小,N、O、C在同一周期,核电荷数越大半径越小,所以从大到小的排列顺序为C>N>O>H;根据气态氢化物的稳定性或最高价氧化物的水化物的酸性即可判断非金属元素的非金属性强弱;(4)利用CS2与CO2分子结构的相似性,CS2的电子式是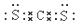 ,CS2熔点高于CO2,其原因是CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大。
,CS2熔点高于CO2,其原因是CS2和CO2都是分子晶体,CS2的相对分子质量大,分子间作用力大。
【思路点拨】本题考查了影响化学反应速率的因素、元素周期表元素周期律、晶体结构等知识,重点要理解元素周期律的内容,难度不大。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
在密闭容器中,充入SO2和18O原子组成的氧气,在一定条件下开始反应,在达到平衡后,18O存在于( )
A.只存在于氧气中 B.只存在于SO3中
C.只存在于SO2和SO3中 D.SO2、SO3、O2中都存在
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于某病人尿糖检验的做法正确的是( )
A.取尿样,加入新制Cu(OH)2悬浊液,观察发生的现象
B.取尿样,加H2SO4中和碱性,再加入新制Cu(OH)2悬浊液,观察发生的现象
C.取尿样,加入新制Cu(OH)2悬浊液,煮沸,观察发生的现象
D.取尿样,加入Cu(OH)2悬浊液,煮沸,观察发生的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L; W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径: W>Z>Y>X>M B.XZ2、X2M2、W2Z2均为直线形的共价化合物
C.由X元素形成的单质不一定是导体
D.由 X、Y、Z、M四种元素形成的化合物一定既含有离子键,又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如右图所示。W元素的简单离子半径在同周期元素的简单离子中最小。下列说法中正确的是( )

A.原子半径由小到大的顺序为:Y < X < W < Z
B.X元素最高价氧化物分子的比例模型为
C.Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性
D.W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备。
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是 ( )。
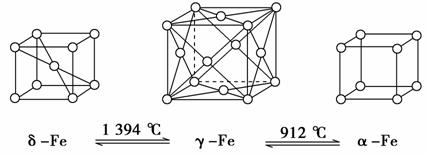
A.γFe晶体中与每个铁原子距离相等且最近的铁原子有6个
B.αFe晶体中与每个铁原子距离相等且最近的铁原子有6个
C.将铁加热到1 500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
D.三种同素异形体的性质相同
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物YX2、ZX2中X、Y、Z都是前三周期元素,X与Y同周期,Y与Z同主族,Y元素原子最外层的p轨道中的电子数等于前一电子层的电子总数,X原子最外层的p轨道中有一个轨道填充了2个电子。则
(1)X原子的电子排布式是____________,Y原子的价层电子排布图是________________。
(2)YX2的分子构型是________,YX2的熔、沸点比ZX2________(填“高”或“低”),理由是_____________________________________________________。
(3)YX2分子中,Y原子的杂化类型是________,YX2分子中含________个π
键。
(4)下图表示一些晶体的结构(晶胞),其中代表YX2的是________,代表ZX2
的是________(填序号,下同)。
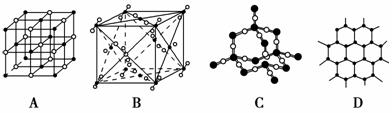
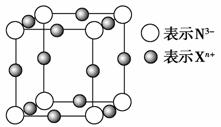 (5)元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。
(5)元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。
①该晶体的阳离子与阴离子个数比为
________。
②该晶体中Xn+离子中n=________。
③X元素的原子序数是________。
④晶体中每个N3-被________个等距离的Xn+离子包围。
查看答案和解析>>
科目:高中化学 来源: 题型:
1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成3种不同的一氯取代物。该烃的结构简式是( )

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com