
(12分)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为: Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3CO]Ac 。完成下列填空:
[Cu(NH3)3CO]Ac 。完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是 。(选填编号)
A.减压 B.增加NH3的浓度 C.升温 D.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式_____________________
(3)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为__________________。通过比较_____________________________可判断氮、磷两种非金属元素的非金属性强弱。
(4)已知CS2与CO2分子结构相似,CS2的电子式是_________________。CS2熔点高于CO2,其原因是 。
(1) B、C;(2)2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3;
(3)C>N>O>H;NH3和PH3的稳定性或最高价含氧酸的酸性。
(4)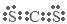 ,CS2和CO2都是分子晶体,相对分子质量CS2大,分子间作用力就大。
,CS2和CO2都是分子晶体,相对分子质量CS2大,分子间作用力就大。
【解析】
试题分析:(1) A.减压,物质的浓度减小,化学反应速率减小,错误; B.增加NH3的浓度,化学反应速率加快,正确; C.升温,化学反应速率加快,正确; D.及时移走产物,物质的浓度减小,化学反应速率减小,错误;(2)铜液中的氨可吸收二氧化碳,该反应的化学方程式是2NH3+CO2+H2O=(NH4)2CO3、(NH4)2CO3+CO2+H2O=2NH4HCO3;(3)铜液的组成元素中,含有的短周期元素有H、C、N 、O;在这些元素中,同一周期的元素,原子序数越大,原子半径就越小;不同周期的元素,原子核外电子层数越多,原子半径就越大。所以短周期元素原子半径从大到小的排列顺序为C>N>O>H;元素的非金属性越强,其相应的氢化物的稳定性就越强,对应的最高价氧化物的水化物的酸性就越强。所以可以通过比较NH3和PH3的稳定性或HNO3、H3PO4的酸性判断元素的非金属性的强弱。(4) CS2与CO2分子结构相似,都是直线型分子,原子间通过形成四对共用电子对结合,电子式是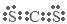 ,在固态时CS2和CO2都是分子晶体,结构相似,大于结构相似的物质来说,相对分子质量越大,分子间作用力就越大,克服分子间作用力使物质熔化或气化消耗的能量就越高,物质的熔沸点就越高。由于相对分子质量CS2大,所以分子间作用力CS2就大,因此。熔点CS2>CO2。
,在固态时CS2和CO2都是分子晶体,结构相似,大于结构相似的物质来说,相对分子质量越大,分子间作用力就越大,克服分子间作用力使物质熔化或气化消耗的能量就越高,物质的熔沸点就越高。由于相对分子质量CS2大,所以分子间作用力CS2就大,因此。熔点CS2>CO2。
考点:考查影响化学反应速率的因素、物质的化学性质的方程式表示、原子半径的大小比较、元素的非金属性强弱比较的方法、


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:选择题
下列各组离子,在指定的环境中一定能大量共存的是
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、C1-、SCN-
B.含有大量HCO3-的溶液:NH4+、Ca2+、Mg2+、I-
C.c(S2-)=0.1 mol·L-1的溶液中:Na+、NH4+、ClO-、SO42-
D.含有大量MnO4-的溶液:H+、Mg2+、SO32-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列物质的转化在给定条件下能实现的是
①NH3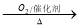 NO2
NO2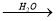 HNO3
HNO3
②CaCl2
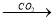 CaCO3
CaCO3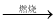 CaO
CaO
③NaAlO2(aq)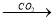 Al(OH)3
Al(OH)3 Al2O3
Al2O3
④MgO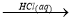 MgCl2(aq)
MgCl2(aq)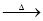 无水MgCl2
无水MgCl2
⑤饱和NaCl(aq)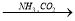 NaHCO3
NaHCO3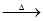 Na2CO3
Na2CO3
A.①② B.③⑤ C.②③④ D.③④⑤
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
下列电离方程式错误的是 ( )
A.Al2(SO4)3=2Al3+ + 3SO42-
B.NaHCO3=Na+ + H+ + CO32-
C.Ba(OH)2= Ba2+ + 2 OH-
D.NaHSO4=Na++H++SO42-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次质量检测化学试卷(解析版) 题型:选择题
0.1 mol NaHCO3中含有 ( )
A.0.2 mol Na+ B.0.05 mol CO C.6.02×1023个 O D.0.1 mol H
C.6.02×1023个 O D.0.1 mol H
查看答案和解析>>
科目:高中化学 来源:2015届江苏省中学高三上学期第一次月考化学试卷(解析版) 题型:填空题
(12分)为探索工业废料的再利用,某化学兴趣小组设计了如下实验流程,用含有铝、铁和铜的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
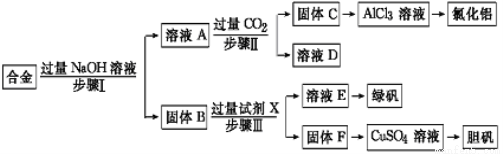
请回答:
(1)写出步骤Ⅰ反应的离子方程式: 。
(2)试剂X是 。步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 。
(3)进行步骤Ⅱ时,该小组用如下图所示装置及试剂制取CO2并将制得的气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
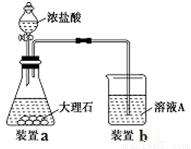
(4)用固体F制备CuSO4溶液,可设计以下三种途径:

写出途径①中反应的离子方程式 ,请选出你认为的最佳途径并说明选择的理由 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省中学高三上学期第一次月考化学试卷(解析版) 题型:选择题
实验室可用NaNO2+NH4Cl==NaCl+N2↑+2H2O制备N2,下列说法正确的是()
A.NaNO2发生氧化反应 B.NH4Cl中的氮元素被还原
C.N2既是氧化产物,又是还原产物 D.每生成1mol N2转移电子的物质的量为6mol
查看答案和解析>>
科目:高中化学 来源:2015届广东省高三9月月考化学试卷(解析版) 题型:选择题
下列离子在溶液中能大量共存的一组是( )
A.Fe2+、H+、ClO-、SO32- B.K+、Al3+、Cl-、CO32-
C.Na+、Ca2+、HCO3-、OH- D.Fe2+、NH4+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源:2015届江苏连云港市高三上第一次月考化学试卷(解析版) 题型:选择题
熔融烧碱应选用的器皿是( )
A.石英坩埚 B.普通玻璃坩埚 C.生铁坩埚 D.陶瓷坩埚
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com