
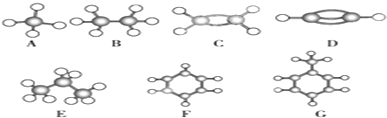
分析 根据球棍模型可知,A为CH4,B为CH3CH3,C为CH2=CH2,D为CH≡CH,E为CH3CH2CH3,F为苯,G为甲苯,
(1)常温下,分子中含有碳原子个数不大于4的烃为气态烃,根据其球棍模型判断,分子中含有碳氢原子个数比最大即为含碳量最高的.
(2)含有碳碳双键或三键或苯环的烃能发生加成反应;
(3)实验室用碳化钙和水反应制取乙炔;
(4)苯和硝酸在浓硫酸作催化剂、加热条件下制取硝基苯.
解答 解:根据图示结构可知:A为甲烷,B为乙烷,C为乙烯,D为乙炔,E为丙烷,F为苯,G为甲苯,
(1)常温下,分子中含有碳原子个数不大于4的烃为气态烃,根据其球棍模型判断,分子中含有碳氢原子个数比最大即为含碳量最高的,所以含碳量最大的是乙炔.
故答案为:D.
(2)含有碳碳双键或三键或苯环的烃能发生加成反应,所以乙烯、乙炔、苯和甲苯都能发生加成反应,所以是4种;
故答案为:4;
(3)实验室用碳化钙和水反应制取乙炔,反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(4)在浓硫酸作催化剂、加热条件下苯和浓硝酸反应生成硝基苯,反应方程式为: +HNO3(浓)$→_{△}^{浓硫酸}$
+HNO3(浓)$→_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为:硝基苯.
点评 本题考查了有机物结构与性质、球棍模型的表示方法、有机反应方程式的书写,题目难度中等,注意掌握常见有机物结构与性质,明确球棍模型表示的意义是解答本题关键.


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:选择题
| A. | c(OH-)前者大于后者 | |
| B. | 与同浓度的盐酸反应时的反应速率前者大于后者 | |
| C. | 分别加入1L的0.2 mol/L的HNO3 后一定产生4.48LCO2 | |
| D. | 溶液中阳离子浓度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下测定其pH等于7 | |
| B. | 一个标准大气压下测定其沸点为100℃ | |
| C. | 电解时产生H2、O2的体积比为2:1 | |
| D. | 室温时为无色的液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)下列数据是对应物质的熔点(℃)
(1)下列数据是对应物质的熔点(℃)| NaCl | Na2O | AlF3 | AlCl3 | BCl3 | Al2O3 | CO2 | SiO2 |
| 801 | 920 | 1291 | 190 | -109 | 2073 | -57 | 1723 |
 )所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.
)所示.SiO2晶体中Si原子数目和Si-O键数目的比例为1:4.| 化学键 | Si-O | Si-Si | O=O |
| 键能/KJ•mol-1 | 460 | 176 | 498 |
 )之间脱去两个水分子产物,其结构式为
)之间脱去两个水分子产物,其结构式为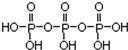 .三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.
.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为Na5P3O10.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32gO2和O3的混合气体中含有的氧原子数为2NA | |
| B. | 常温常压下,1mol氦气含有的核外电子数为4NA | |
| C. | 0.1 mol•L-1稀硫酸中硫酸根离子个数为0.1 NA | |
| D. | 22gCO2与11.2LHCl含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI $\frac{\underline{\;高温\;}}{\;}$ CeI4+2H2↑ | |
| B. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+═Ce3++2Fe3+ | |
| C. | 金属Ce保存时,应该隔绝空气和水 | |
| D. | 铈的四种核素136 58Ce、138 58Ce、140 58Ce、142 58Ce,它们互称为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两个相邻同系物的分子量数值一定相差14 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 分子为C3H8与C6H14的两种有机物一定互为同系物 | |
| D. | 分子组成相差一个或几个CH2原子团的化合物必定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com