
 I:能源是人类生活和社会发展的基础,地球上最基本的能源是太阳能,大自然利用这一能源最成功的是植物的光合作用.氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ•g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水.)请写出氢气燃烧的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(1);△H=-286kJ•mol-1或2H2(g)+O2(g)=2H2O(l)△H=-572KJ•mol-1.
I:能源是人类生活和社会发展的基础,地球上最基本的能源是太阳能,大自然利用这一能源最成功的是植物的光合作用.氢气被人们看作理想的绿色能源,己知氢气的热值是143kJ•g-1(热值指的是在一定条件下单位质量的物质完全燃烧所放出的热量,氢气转化为液态水.)请写出氢气燃烧的热化学方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(1);△H=-286kJ•mol-1或2H2(g)+O2(g)=2H2O(l)△H=-572KJ•mol-1.分析 Ⅰ:根据氢气的热值计算1mol氢气的燃烧热,进而书写热化学方程式;
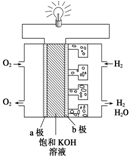
Ⅱ:碱性氢氧燃料电池中,通入氢气的一极为负极,发生氧化反应,通入氧气的一极为原电池的正极,发生还原反应;
Ⅲ:根据电池方程式结合化合价的变化判断正负极材料以及电极反应式.
解答 解:Ⅰ:地球上的能源主要来源于太阳能,通过植物的光合作用被循环利用,
由氢气的热值可知,1gH2燃烧放出的热量为143kJ,则1molH2放出的热量为:2×143kJ=286kJ,
所以氢气燃烧热的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(1);△H=-286kJ•mol-1或2H2(g)+O2(g)=2H2O(l)△H=-572KJ•mol-1,
故答案为:太阳能;植物的光合作用;H2(g)+$\frac{1}{2}$O2(g)=H2O(1);△H=-286kJ•mol-1或2H2(g)+O2(g)=2H2O(l)△H=-572KJ•mol-1;
Ⅱ:①氢氧碱性燃料电池,负极发生氧化反应,氢气在负极放电,a为负极,电极反应式为H2+2OH--2e-=2H2O,正极发生还原反应,氧气在正极放电,b为正极,电极反应式O2+2H2O+4e-=4OH-,
故答案为:负;正;H2+2OH--2e-=2H2O;O2+2H2O+4e-=4OH-;
②n(H2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,由电极方程式可知转移1mol电子,数目为NA个,故答案为:NA;
Ⅲ:电池反应式为2FeCl3+Cu=2FeCl2+CuCl2,反应中Cu被氧化,应为原电池的负极,电极反应式为Cu-2e-=Cu2+,FeCl3在正极上得电子被还原,电极反应式为2Fe3++2e-=2Fe2+,故答案为:Cu;Fe3++2e-=2Fe2+.
点评 本题考查较为综合,涉及热化学方程式、原电池,为高频考点,侧重于学生的分析、计算能力的考查,题目难度不大,注意热化学方程式以及电极反应式的书写方法.


科目:高中化学 来源: 题型:选择题
| A. | 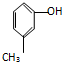 和 和  | B. | 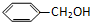 和 和  | ||
| C. | (CH3)2C(OH)CH2CH3 和CH3CH2OH | D. | CH3CH2OH 和 CH3CH2OCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 位于第八周期,第ⅡA族 | |
| B. | 最高价氧化物对应水化物具有强碱性 | |
| C. | 此元素的原子半径较大,熔沸点很高 | |
| D. | 属于人造元素,自然界不存在,并具有放射性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通式相同的不同有机物一定属于同系物 | |
| B. | 具有相同官能团的有机物不一定是同系物 | |
| C. | 互称为同分异构体的物质不可能具有相同的通式 | |
| D. | 互为同分异构体的物质之间物理性质一定不同,但化学性质一定相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 B.
B.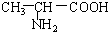 与
与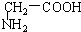
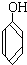 与
与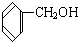 D.CH3CH2C≡CH与CH2=CH-CH=CH2
D.CH3CH2C≡CH与CH2=CH-CH=CH2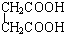 与
与 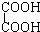 F.戊烯和环戊烷
F.戊烯和环戊烷查看答案和解析>>
科目:高中化学 来源: 题型:解答题
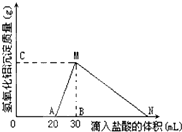 在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示.问:
在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示.问:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2,Q2=2Q3 | B. | Q1=Q2=Q3 | C. | Q1<Q2,Q3=$\frac{{Q}_{1}}{2}$ | D. | 无法比较 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com