
| A、铁粉和氯化铁溶液反应 Fe+Fe3+═Fe2+ |
| B、铁和稀盐酸反应 Fe+2H+═Fe2++H2↑ |
| C、氯气通入水中:Cl2+H2O=2H++Cl-+ClO- |
| D、铝和氢氧化钠溶液反应 2Al+2OH-=2AlO2-+3H2↑ |


科目:高中化学 来源: 题型:
| ||
| A、1mol KClO3参加反应,生成气体的体积为44.8L |
| B、H2C2O4在反应中被还原 |
| C、ClO2是氧化产物,它可用来净水,在净水时作氧化剂 |
| D、生成1mol ClO2,反应中转移的电子有1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中只有X是短周期的金属元素,下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中只有X是短周期的金属元素,下列判断正确的是( )| A、X的最高价氧化物能溶于强碱 |
| B、非金属性:T<R |
| C、气态氢化物稳定性:T>Z |
| D、R与Q的原子核外电子数相差16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是极性分子 |
| B、键长:N≡C大于C≡C |
C、CN-的电子式: |
| D、能与烯烃发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| TiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
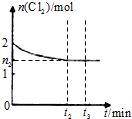 光气(COCl2)、联氨(N2H4)和H2O2具有重要的工业价值.
光气(COCl2)、联氨(N2H4)和H2O2具有重要的工业价值.| 容器 | 反应物 投入的量 | 平衡时 n(Cl2)/mol | 达到平衡 所需时间/min | 平衡时 能量变化/kJ |
| 甲 | 1mol COCl2 | n1 | t1 | 吸热Q1 |
| 乙 | 2mol Cl2和2mol CO | n2 | t2 | 放热Q2 |
| 丙 | 2mol COCl2 | n3 | t3 | 吸热Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、①②③ |
| C、①②③④ | D、①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com