
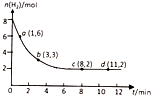
| A. | 升高温度,平衡常数将变大 | B. | 0~1min,v(CO2)=0.1mol/(L•min) | ||
| C. | 达到平衡时,氢气的转化率为75% | D. | 到达平衡时,甲醇的体积分数为20% |
分析 A.该反应为放热反应,升高温度后平衡向着逆向移动,则平衡常数减小;
B.0~1min,氢气的物质的量从8mol变为6mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算出氢气的反应速率,然后根据反应速率与计量数成正比计算出二氧化碳的平均反应速率;
C.转化率=$\frac{反应消耗的物质的量}{反应前总的物质的量}$×100%,据此计算出氢气的转化率;
D.平衡时消耗了6mol氢气,据此可计算出平衡时甲醇的物质的量,然后利用差量法计算出平衡时气体减小的总物质的量,最后计算出甲醇的体积分数.
解答 解:A.该反应为放热反应,升高温度后平衡向着逆向移动,则反应物浓度增大,生成物浓度减小,所以平衡常数会减小,故A错误;
B.0~1min,氢气的物质的量从8mol变为6mol,氢气消耗了2mol,则v(H2)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{2mol}{20L}}{1min}$=0.1mol/(L•min),则v(CO2)=$\frac{1}{3}$v(H2)=$\frac{0.1}{3}$mol/(L•min),故B错误;
C.平衡时氢气的物质的量为2mol,则平衡时消耗氢气的物质的量为:8mol-2mol=6mol,则氢气的转化率为:$\frac{6mol}{8mol}$×100%=75%,故C正确;
D.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△n(减小)
3 1 2
6mol n△n
则平衡时混合气体减小的物质的量为:△n=$\frac{6mol×2}{3}$=4mol,则平衡时气体的总物质的量为:6mol+8mol-4mol=10mol,
平衡时生成甲醇的物质的量为n=$\frac{6mol×1}{3}$=2mol,所以甲醇的体积分数为:$\frac{2mol}{10mol}$×100%=20%,故D正确;
故选CD.
点评 本题考查了物质的量随时间变化的曲线,题目难度中等,明确化学平衡特征及影响因素为解答关键,注意掌握化学反应速率、转化率的概念及表达式,D为难点,注意差量法的应用,试题培养了学生的分析能力及化学计算能力.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:9 | B. | 9:1 | C. | 1:11 | D. | 11:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界硅元素的贮量丰富,并存在大量的单质硅 | |
| B. | 硅可由二氧化硅还原制得 | |
| C. | 二氧化硅晶体--水晶可用于制造光学仪器等 | |
| D. | 生活中常见的硅酸盐材料有玻璃、水泥、陶瓷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
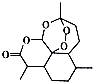
| A. | 属于芳香族化合物 | B. | 能存在于热的氢氧化钠溶液中 | ||
| C. | 易溶于氯仿等有机溶剂 | D. | 分子结构中只含有极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +
+ $\stackrel{△}{→}$
$\stackrel{△}{→}$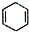 .下列有关说法不正确的是( )
.下列有关说法不正确的是( )| A. | D-A反应属于加成反应 | |
| B. | 2-甲基-1,3-丁二烯和丙烯发生D-A反应产物只有一种 | |
| C. | 如果要合成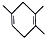 所用的原始原料可以是2,3-二甲基-1,3-丁二烯和丙炔 所用的原始原料可以是2,3-二甲基-1,3-丁二烯和丙炔 | |
| D. | D-A反应中的产物都可以使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | Z | W |
| A. | X、Y、Z、W中至少有一种是金属元素 | |
| B. | 元素的最高化合价:W>Z>Y | |
| C. | 简单离子半径由大到小的顺序:W>Z>Y>X | |
| D. | 一定条件下,W的单质可以置换出Z的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验现象 | 解释 |
| A | Cl2和SO2均可使含有酚酞的NaOH溶液褪色 | Cl2和SO2均具有漂白性 |
| B | Fe与稀硝酸、稀硫酸反应均有气泡产生 | Fe与两种酸均发生置换反应 |
| C | 某物质燃烧后的产物既能使白色硫酸铜粉末变蓝,又能使澄清石灰水变浑浊 | 该物质可能是碳氢化合物 |
| D | 向某有机物的水溶液中加Na产生大量气体 | 该有机物中可能含有羟基或羧基 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应在常温下不一定能够自发进行 | |
| B. | 合成氨反应需使用催化剂,目的是促进该反应平衡向生成氨的方向移动 | |
| C. | 0.1 mol•L-1Na2CO3溶液在35℃时碱性比25℃强,说明Na2CO3水解是吸热反应 | |
| D. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向苯酚钠溶液通入少量的CO2:2O-+CO2+H2O-→2OH+CO32- | |
| B. | 用稀硝酸洗涤试管内壁的银镜:Ag+4H++NO3-═Ag++NO↑+2H2O | |
| C. | (NH4)2Fe(SO4)2溶液与过量Ba(OH)2溶液混合:Fe2++2SO42-+2Ba2++2OH-═Fe(OH)2↓+2BaSO4↓ | |
| D. | 常温下,向澄清石灰水中通入Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com