
青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)
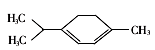
A.5种 B.6种 C.7种 D.8种
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
下列关于卤族元素的说法正确的是
A.F、Cl、Br、I最高正化合价都为+7
B.卤族元素的单质只有氧化性
C.从F到I,原子的得电子能力依次减弱
D.卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由难变易
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高二下第四次半月考化学试卷(解析版) 题型:选择题
已知酸性大小:羧酸>碳酸>酚。下列含溴化合物中的溴原子在适当的条件下都能被羟基取代,所得产物能跟NaHCO3溶液反应的是( )
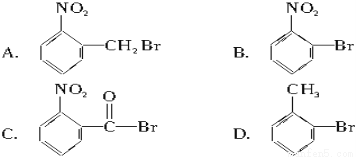
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北沙市高二下第四次半月考化学试卷(解析版) 题型:选择题
下列化学用语的表达正确的是( )
A.原子核内有10个中子的氧原子: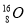
B.二氧化碳的比例模型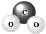
C.Fe3+的最外层电子排布式为:3s23p63d5
D.基态铜原子的外围电子排布图为:
查看答案和解析>>
科目:高中化学 来源:2016届山西省高三5月月考理综化学试卷(解析版) 题型:选择题
已知:常温下浓度为0.1mol/L的下列溶液的pH如表:
溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 7.5 | 11.6 | 9.7 | 8.3 |
下列有关说法正确的是( )
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF
B.等体积等物质的量浓度的NaClO溶液与NaF溶液中离子总数大小:N前<N后
C.若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)= 0.1mol/L
D.向Na2CO3溶液中通入少量的HF气体,化学反应方程式为: Na2CO3 + 2HF = CO2 + H2O + 2NaF
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月高考模拟理综化学试卷(解析版) 题型:实验题
为减少铬渣的危害并从中提取硫酸钠,设计工艺如下:
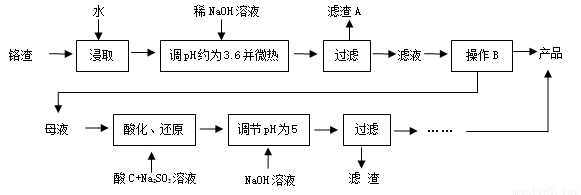
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+
②Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
(1)“微热”的作用:① ;② 。
(2)根据溶解度(S)~温度(T)曲线,操作B的最佳方法为 (填字母)
a. 蒸发浓缩,趁热过滤 b. 蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为 ;酸C为 ,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]= 。
(4)已知Cr(OH)3在溶液中存在平衡H++CrO2-(亮绿色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-,加入NaOH溶液时要控制pH为5,pH不能过高的理由是 。
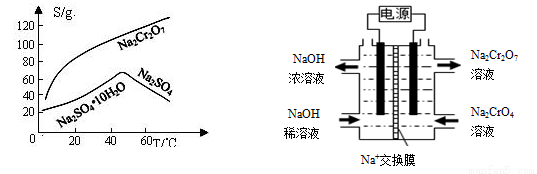
(5)根据2CrO42-+2H+ Cr2O72-+H2O设计上图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中左侧电极连接电源的 极,电解制备过程的总反应方程式为 。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为d,则此时Na2CrO4的转化率为 。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为 。
Cr2O72-+H2O设计上图装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中左侧电极连接电源的 极,电解制备过程的总反应方程式为 。测定阳极液中Na和Cr的含量,若Na与Cr的物质的量之比为d,则此时Na2CrO4的转化率为 。若选择用熔融K2CO3作介质的甲醇(CH3OH)燃料电池充当电源,则负极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三5月高考模拟理综化学试卷(解析版) 题型:选择题
第三周期元素,浓度均为0.01 mol/L的最高价氧化物对应水化物的pH与原子半径的关系如右图所示。则下列说法正确的是

A.气态氢化物的稳定性:N>R
B.Z的最高价氧化物对应的水化物能溶于稀氨水
C.Y和R形成的化合物既含离子键又含共价键
D.X和M两者最高价氧化物对应的水化物恰好完全反应后溶液的pH>7
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川成都七中高一下课后作业乙烯化学试卷(解析版) 题型:实验题
下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验,完成下列各小题。

(1)碎瓷片的作用是_____________。
(2)B中现象是________,乙烯发生_______反应。
(3)C中现象是________,发生反应的化学方程式______________________。
(4)在D处点燃时必须进行的操作是___________________________。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省师大一附高三5月月考理综化学试卷(解析版) 题型:实验题
硫酸亚铁晶体(FeSO4· 7H2O)俗称绿矾,加热至高温会分解。某化学研究小组利用下列装置探究FeSO4分解后的产物。
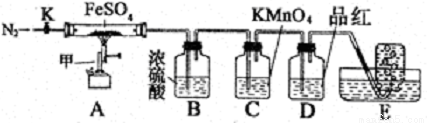
实验步骤:
按图组装好仪器(已省略夹持仪器)并检查装置的气密性,准确称取mgFeSO4固体置于硬质玻璃管中,将E中的导管撤出水槽,打开活塞K,通入一段时间的N2,关闭活塞K。加热A中的玻璃管一段时间后,将E中导管置于水槽集气瓶口收集产生的,用带火星的木条检验E中所收集的气体,带火星的木条能够复燃。待A中固体不再分解后,停止加热,打开K,缓慢通入氮气至玻璃管冷却,得到红棕色粉末。请回答下列问题:
(1)仪器甲的名称是__________;
(2)B中浓硫酸的作用__________。
(3)实验过程中发现C中溶液颜色变浅,D中无明显变化。写出C中发生反应的离子方程式__________;
(4) FeSO4完全分解后,还需要通入一段时间N2的原因是__________。
(5)若C中原先加入了20mL 1.00mol/L的KMnO4溶液,为了确定FeSO4分解的化学方程式,某同学进行了如下实验:
Ⅰ、称量B装置在实验前后增重 0.80g;
Ⅱ、将实验后C中的溶液全部转移至100mL容量瓶中,并加水稀释至刻度线;
Ⅲ、准确量取20.00mL溶液至锥形瓶中,加入足量稀硫酸酸化,用0.20mo1/L标准H2C2O4溶液滴定至终点:
Ⅳ、重复实验3次.记录数据如下:
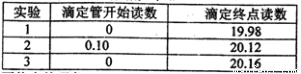
①滴定至终点的现象__________。
②FeSO4分解的化学方程式为__________。
(6)请设计一个实验来检验A中的FeSO4是否完全分解__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com