
��ͼװ���У�a��250
mL����ƿ������ʢ�б�״���µĿ�����O2ռ![]() ����1.2 mol•L��1����10
mL��b��δ�����ҷ���0.384 g Cu�۵�����C�Ǽн��ĵ��ɼУ�d��ʢ������Na2O2�ĸ���ܣ�e�dz���CO2��ע����������װ�ò�©����
����1.2 mol•L��1����10
mL��b��δ�����ҷ���0.384 g Cu�۵�����C�Ǽн��ĵ��ɼУ�d��ʢ������Na2O2�ĸ���ܣ�e�dz���CO2��ע����������װ�ò�©����

��1��������b�е�Cu��С�ĵ�����ƿ�У�ҪʹCu�۷�����Ӧ���Ƿ�һ����Ҫ�Է�Ӧ�������м��ȣ���ǡ������� ��������Ӧ�Ļ�ѧ����ʽ������������������ ����ַ�Ӧ��Cu����ʣ�࣬�ڷ�Ӧ�����пɹ۲쵽�������ǣ��������������� �������������������� �������������������� �������������������������������� ��
��2�����ӿ�ͭ������ķ�Ӧ���ʣ��ɲ��ö��ֲ�ͬ�Ĵ�ʩ�������û�ѧ�Լ����������Լ��п���ʹ�õ��ǣ�����ţ����� ��
A������ˮ���� B����ˮ���������� C��ʯī ���� D��AgNO3��������
��3������ƿ����������������С��ֱ����������ƿ�ڣ�������һ�����ԭ���ǣ��û�ѧ����ʽ��ʾ������ ���������������������������� ��
��4�����ɼн�CO2���������ڼ�����ʹ���������塢������Һ����ֽӴ�����ʹʣ��ͭ����ȫ�ܽ⣬��������������һ���ܻ�ѧ����ʽ��ʾ��Ϊ��������������
��������������������
���ڴ˹����У�������ҪCO2
������������ mL������״����
��1����3Cu��8HNO3(ϡ)=3Cu(NO3)2��2NO����4H2O ��Һ������ɫ����ð������ƿ����ɫ������ɺ���ɫ�����������ͣ�����Һ����ɫ�� ��2��C D ��3��4NO��3O2��2H2O=4HNO3��4NO2��O2��2H2O=4HNO3��2NO��O2=2NO2���� 3NO2��H2O=2HNO3��NO ��4��2Cu��O2��4HNO3=2Cu(NO3)2��2H2O�� 34.4
|
��b�е�ͭ�۵�����ƿ�У�ͭ����ƿ�е�ϡ���ᷢ����Ӧ����������ͭ��ɫ��Һ����ɫ��NO���壬����Һ���ݳ���������ƿ���п����������е����������ɵ�NO������Ӧ��ɺ���ɫ��NO2������������ʹ�������͡� ���ӿ�ͭ������ķ�Ӧ���ʣ��ɼ���ʯī����������Һ��ͭ�γ�ԭ��ء�����ƿ��������ƿ�е�NO��NO2������е�O2����Һ�е�ˮ��Ӧ��������4NO��3O2��2H2O=4HNO3��4NO2��O2��2H2O=4HNO3��ʹ��ƿ������ѹǿ��С�����ϱ�С��ֱ��������ƿ�С��������̷���������Ӧ��3Cu��8HNO3(ϡ)=3Cu(NO3)2��2NO����4H2O��4NO��3O2��2H2O=4HNO3����������Ӧ��ӣ����õ��ܷ�Ӧ����ʽΪ�� 2Cu��O2��4HNO3=2Cu(NO3)2��2H2O�����ݴ˷�Ӧ����ʽ�жϳ�ͭ��������Ҫʹͭ��ȫ��Ӧ��������67.2 mL������ƿ�п����ﺬ������250 mL��1/5=50 mL������Ҫ����67.2 mL ��50 mL=17.2 mL�� �����������������Ĺ�ϵ������ɵã� O2 �� 2CO2 22400 mL���� 2��22400 mL 17.2 mL�������� x
x=34.4 mL ������Ҫ������̼34.4 mL��
|


 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 ��ͼװ�ÿ����ڶ����ʵ�飮ͼ�мг̶ֹ�װ������ȥ�����п̶ȣ��������ã�
��ͼװ�ÿ����ڶ����ʵ�飮ͼ�мг̶ֹ�װ������ȥ�����п̶ȣ��������ã�| ����Һ | ����Һ | �������/mL | ��Ӧʱ�� | |
| ��ʵ��A�� | ��ʵ��B�� | ��25�桢101 kPa�� | ʵ��A | ʵ��B |
| CH3COOH0.1 mol/L40.00mL | HCl��Һ 0.1 mol/L 40.00mL |
5 | t��a1��=155 s | t��b1��=7 s |
| 10 | t��a2��=310 s | t��b2��=16 s | ||
| 15 | t��a3��=465 s | t��b3��=30 s | ||
| 20 | t��a4��=665 s | t��b4��=54 s | ||
| �� | �� | �� | ||
| 65V��10-3 |
| 2��SVm |
| 65V��10-3 |
| 2��SVm |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�





�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
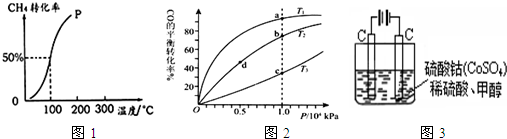
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
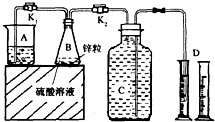 ij��ѧ��ȤС������ͼװ�ý��С�����п�������ᷴӦ��ȡ����������ѡ��̽������B�еĻ�ѧ��Ӧ����ƽ�Ⱥ�ÿ���һ�����ռ�һ����������ͬ�����£�ÿ�����ռ���������������±���
ij��ѧ��ȤС������ͼװ�ý��С�����п�������ᷴӦ��ȡ����������ѡ��̽������B�еĻ�ѧ��Ӧ����ƽ�Ⱥ�ÿ���һ�����ռ�һ����������ͬ�����£�ÿ�����ռ���������������±���| ʵ����� | ����Ũ�� | ��������ͭ��Һ���/mL | ��Ӧ�ﵽƽ�ȵ�ʱ��/min | ��1�����ռ��������/mL | ��2�����ռ��������/mL | ��3�����ռ��������/mL | �� |
| 1 | 20% | 0 | 5.4 | 6.1 | 11.9 | 13.7 | �� |
| 2 | 20% | 0.5 | 2.5 | 23.9 | 32.1 | 33.5 | �� |
| 3 | 30% | 0.5 | 1.1 | 60.7 | 89.9 | 90.1 | �� |
| 4 | a% | 3.0 | 0.8 | 55.7 | 66.0 | 61.4 | �� |
| 2 |
| 5 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com