
|
一定量的(NH4)2SO4与NH3·H2O混合所得的碱性溶液中,下列说法错误的是 | |
| [ ] | |
A. |
c (OH-)>c(H+) |
B. |
c (NH4+)+c(H+)=2c(SO |
C. |
c (NH4+)<2c(SO |
D. |
c (NH4+)>2c(SO |
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:
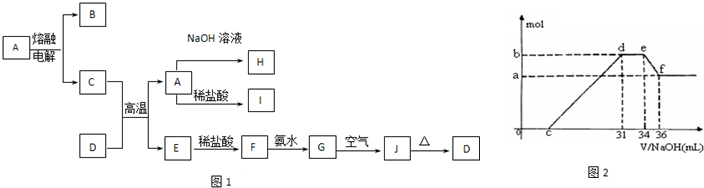
查看答案和解析>>
科目:高中化学 来源: 题型:
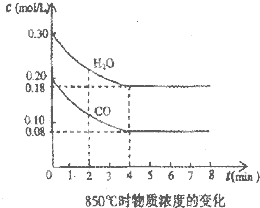 Ⅰ、(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为
Ⅰ、(1)在25℃条件下将pH=3的醋酸稀释100倍后溶液的pH为查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(浙江卷带解析) 题型:填空题
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。
目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)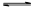 (NH4)2CO3(aq) △H1
(NH4)2CO3(aq) △H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)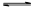 (NH4)2HCO3(aq) △H2
(NH4)2HCO3(aq) △H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g) 2(NH4)2HCO3(aq) △H3
2(NH4)2HCO3(aq) △H3
请回答下列问题:
(1)△H3与△H1、△H2之间的关系是:△H3 。
(2)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①△H3 0(填>、=或<)。
②在T1~T2及T4~T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,
其原因是 。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度上升到T2,并维持该温度。请在图中画出t1时刻后溶液的pH变化总趋势曲线。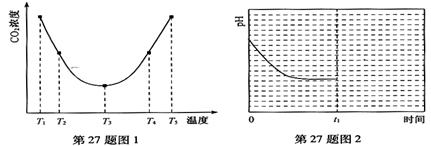
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有 (写出2个)。
(4)下列物质中也可能作为CO2捕获剂的是 。
| A.NH4Cl | B.Na2CO3 |
| C.HOCH2CH2OH | D.HOCH2CH2NH2 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省镇江市高三上学期期末考试化学试卷(解析版) 题型:填空题
污染与环境保护已经成为现在我国最热门的一个课题,污染分为空气污染,水污染,土壤污染等。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+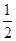 O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+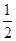 O2(g)=CO(g) ΔH2=-110.5
kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5
kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式: 。
该反应的平衡常数表达式为K= 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (选填序号)。
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)为了减少空气中的CO2,目前捕碳技术在降低温室气体排放中具有重要的作用,捕碳剂常用(NH4)2CO3,反应为:(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH3为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图,则:

①ΔH3 0(填“>”、“=”或“<”)。
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是: 。
(3)催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强。则反应离子方程式为: 。
②电化学降解NO3-的原理如图,电源正极为: (选填填“A”或“B”),阴极反应式为: 。
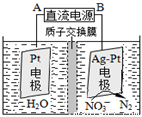
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(浙江卷解析版) 题型:填空题
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。
目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:2NH3(l)+H2O(l)+CO2(g)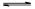 (NH4)2CO3(aq)
△H1
(NH4)2CO3(aq)
△H1
反应Ⅱ:NH3(l)+H2O(l)+CO2(g)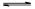 (NH4)2HCO3(aq) △H2
(NH4)2HCO3(aq) △H2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)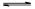 2(NH4)2HCO3(aq) △H3
2(NH4)2HCO3(aq) △H3
请回答下列问题:
(1)△H3与△H1、△H2之间的关系是:△H3 。
(2)为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①△H3 0(填>、=或<)。
②在T1~T2及T4~T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,
其原因是 。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度上升到T2,并维持该温度。请在图中画出t1时刻后溶液的pH变化总趋势曲线。
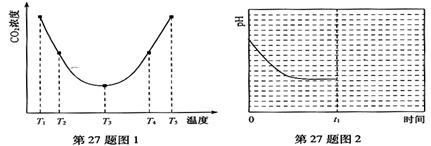
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有 (写出2个)。
(4)下列物质中也可能作为CO2捕获剂的是 。
A.NH4Cl B.Na2CO3
C.HOCH2CH2OH D.HOCH2CH2NH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com