
| A、酸性强弱:H3PO4>H2SO4 | B、金属性:Na>Al | C、碱性强弱:NaOH<Mg(OH)2 | D、原子半径:Cl>Na |


科目:高中化学 来源:09—10年梅县东山中学高一下学期期末考试化学卷 题型:填空题
(10分)元素在周期表中的位置,反映了元素的原子结构和元素性质。下图是元素周期表的一部分。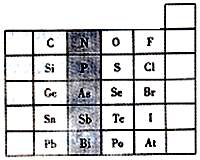
(1)阴影部分中元素N在元素周期表中的位置为第 周期 族,其单质分子中含有的共用电子对数目为 对。
(2)根据元素周期律,请你预测H3AsO4、H3PO4、
的酸性强弱:H3AsO4 H3PO4(填“>”、“<”或“=”)。
(3)在一定条件下,S、Se都能与H2反应,根据元素周期律判断,Se与H2反应比S与H2的反应 。(填“更难”或“更易”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com