
【题目】I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
i. SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+SO2=SO![]() +4H++2I-
+4H++2I-
序号 | ① | ② | ③ | ④ |
试剂 组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验 现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较①快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较①快 |
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中),下列说法不正确的是
A. 水溶液中SO2歧化反应方程式为:3SO2+2H2O =S↓+2H2SO4
B. ②是①的对比实验,则a=0.4
C. 比较①、②、③,可得出结论:I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可加快歧化反应速率
D. 实验表明,SO2的歧化反应速率④>①,原因是反应i比ii快,反应ii中产生的H+是反应i加快
【答案】D
【解析】
A.由i+ii×2得反应:3SO2+2H2O =S↓+2H2SO4,故A项正确;
B.②是①的对比实验,采用控制变量法,②比①多加了0.2mol·L-1 H2SO4,②与①中KI浓度应相等,则a=0.4,故B项正确;
C.对比①与②,加入H+可以加快SO2歧化反应的速率;对比②与③,单独H+不能催化SO2的歧化反应;比较①、②、③,可得出的结论是:I-是SO2歧化反应的催化剂,H+单独存在时不具有催化作用,但H+可以加快歧化反应速率,故C项正确。
D.对比④和①,④中加入碘化钾的浓度小于①,④中多加了碘单质,反应i消耗H+和I-,反应ii中消耗I2,④中“溶液由棕褐色很快褪色,变成黄色,出现浑浊较①快”,反应速率④>①,由此可见,反应ⅱ比反应ⅰ速率快,反应ⅱ产生H+使成c(H+)增大,从而反应i加快,故D项错误;
综上所述,本题正确答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)25℃时,0.1mol/L HCl溶液中由水电离出的H+的浓度为_______;
(2)若向氨水中加入少量硫酸铵固体,此时溶液中![]() 将_______;(填“增大”、“减小”或“不变”)
将_______;(填“增大”、“减小”或“不变”)
(3)25℃时,向AgNO3溶液中加入BaCl2溶液和KBr溶液,当两种沉淀共存时,![]() =____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
=____;[已知:25℃时,Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10 ]
(4)用离子方程式表示NH4F不能用玻璃试剂瓶装的原因________;
(5)25℃时,有下列四种溶液:A. 0.1mol/L CH3COONH4溶液 B. 0.1mol/L CH3COOH溶液 C.0.1mol/L CH3COONa溶液 D.等体积0.4mol/L CH3COOH溶液和0.2mol/L NaOH溶液的混合液(混合液呈酸性)
① 已知A溶液呈中性,试推断(NH4)2CO3溶液呈______性(填“酸”或“碱”或“中”);
② D溶液中除H2O外所有分子、离子浓度由大到小的顺序为________;
③ 上述四种溶液中水的电离程度由小到大的顺序为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以 NA表示阿伏加德罗常数的值,下列说法正确的是
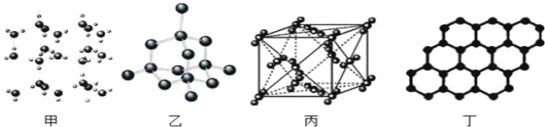
A. 36g冰(图甲)中含共价键数目为4NA
B. 12g金刚石(图乙)中含有σ键数目为4NA
C. 44g干冰(图丙)中含有NA个晶胞结构单元
D. 12g石墨(图丁)中含π键数目3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代宋应星 《天工开物·铜》写到:“凡铜供世用,出山与出炉,止有赤铜。以炉甘石或倭铅参和,转色为黄铜;以砒霜等药制炼为白铜;矾、硝等药制炼为青铜;广锡参和为响铜;倭铅和写﹝泻﹞为铸铜。初质则一味红铜而已。”回答下列问题:
(1)古人描述的倭铅的主要成分不是铅,而是一种位于第四周期的过渡元素,其基态原子的第三能层的能级全部排满,其原子外围电子的排布式为:________________________
(2)在CuSO4溶液中加过量氨水后再向该溶液中加入一定量乙醇会析出[Cu(NH3)4]SO4·H2O,写出此过程中蓝色絮状沉淀滴加过量氨水的离子反应方程式________________________________________,[Cu(NH3)4]SO4·H2O中与Cu2+形成配位键的原子是________(填元素符号),若要确定[Cu(NH3)4]SO4·H2O是晶体还是非晶体,最科学的方法是对其进行_________________实验。
(3)含有钡元素的盐的焰色反应为_______色,许多金属盐都可以发生焰色反应,其原因是______________________
(4)黄铜矿是主要的炼铜原料,CuFeS2是其中铜的主要存在形式。四方晶系CuFeS2晶胞结构如图所示。
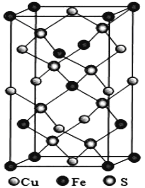
①Cu+的配位数为__________,
②已知:底边a=b=0.524 nm,高c=1.032 nm,NA为阿伏加德罗常数的值,CuFeS2晶体的密度是___________gcm3(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是
A. 由Na和Cl形成离子键的过程:![]()
B. Na2S做沉淀剂可处理含Hg2+的工业污水:Hg2++S2-=HgS↓
C. CH3COOH溶液与NaOH溶液反应放出热量H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
D. 闪锌矿(ZnS)经CuSO4溶液作用转化为铜蓝(CuS):ZnS+Cu2+=CuS+Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示仪器(内含物质)组装成实验装置,可验证木炭与浓H2SO4反应生成CO2,下列有关说法正确的是( )
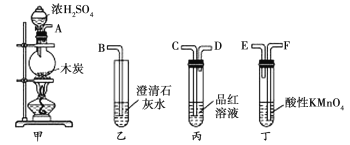
A.上述装置连接的正确顺序是A→E→F→C→D→B
B.SO2和CO2都可与澄清石灰水反应,且原理相同
C.只需观察到乙中澄清石灰水变浑浊这一个现象,即可验证生成CO2
D.将SO2通入酸性高锰酸钾溶液,溶液褪色,体现SO2的漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性![]() >H2CO3 >
>H2CO3 >![]() >HCO3—,现要将
>HCO3—,现要将 转化为
转化为![]() 可行的方法是( )
可行的方法是( )
A. 与足量NaOH溶液共热,再通入足量HClB. 与稀硫酸共热后,加入足量的NaHCO3
C. 加热该物质溶液,再通入足量的CO2D. 加稀硫酸共热后,再加入足量NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如下图,则此有机物可发生的反应类型有( )
①取代反应②加聚反应③消去反应④酯化反应⑤水解反应⑥氧化反应⑦显色反应

A. ①②④⑥⑦B. ②③④⑥⑦C. ①②③④⑤⑥D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废料中含有一定量的单质银。该工厂设计回收单质银的工艺流程如下:

已知:
i.NaClO在酸性条件下易分解,且NaClO氧化Ag的效果远强于NaClO3;
ii.3NaClO![]() 2NaCl+NaClO3。
2NaCl+NaClO3。
请回答下列问题:
(1)“粉碎”的目的为___。
(2)“浸出”时,需加入适量NaCl并保持体系为碱性环境,其中需保持体系为碱性环境的原因为___,发生反应的离子方程式为___。
(3)“浸出”时,所加NaClO可用代替___ (填选项字母),但此法的缺点是___。
A.HNO3 B.NaCl C.Na2S
(4)“溶解”时,发生反应的离子方程式为___。
(5)“还原”时,N2H4·H2O对应的产物为N2。此反应中氧化剂与还原剂的物质的量之比为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com