
在一密闭容器中(容积为2 L),充入氨气5 mol和氧气7.25 mol,并发生如下反应:4NH3+5O2 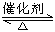 4NO+6H2O(g),此反应在一定条件下进行2 min后达到平衡,测得NH3的物质的量为4 mol.
4NO+6H2O(g),此反应在一定条件下进行2 min后达到平衡,测得NH3的物质的量为4 mol.
(1)生成H2O(g)的物质的量为 ,以NO的浓度变化表示该反应的平均反应速率是_______。
(2)O2的平衡浓度是____________。
(3)NH3的转化率为 。
(4)写出平衡常数的表达式 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年云南省高一下期中化学试卷(解析版) 题型:选择题
生活中下列处理方法正确的是
A.氯气易液化,液氯可以保存在钢瓶中
B.食盐可作调味剂,不能作食品防腐剂
C.纺织品上的油腻用烧碱溶液清洗
D.把铁器具浸入水隔绝空气防生锈
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三5月四模化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.18O2-结构示意图: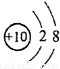
B.硝基苯的结构简式: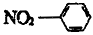
C.NaHSO4熔融时电离方程式:NaHSO4= Na++ HSO4-
D.模型 可表示甲烷分子或四氯化碳分子
可表示甲烷分子或四氯化碳分子
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三5月一模理综化学试卷(解析版) 题型:实验题
锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为
。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+) :c(Ni2+)= 。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三5月一模理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温下1L 0.1 mol﹒L-1的FeSO4溶液中含有0.4NA个氧原子
B.用碱性锌锰干电池作电源电解饱和食盐水,当消耗MnO2 8.7g时,可制得标况下氯气2.24L
C.1.2g CaCO3与Mg3N2的混合物中含有质子数为0.6NA
D.常温下,pH=7的0.5 mol/L的CH3COONH4溶液中,NH4+浓度为0.5 mol﹒L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷(解析版) 题型:选择题
pH=2和pH=4的两种稀硫酸,等体积混合后,下列结论正确的是( )
A.c(H+)=1×10-3 mol·L-1 B.c(OH-)=2×10-12 mol·L-1
C.pH=2.3 D.pH=3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷(解析版) 题型:选择题
在新制的氯水中存在平衡:Cl2+H2O H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
A.H+浓度减小,HClO浓度减小 B.H+浓度增大,HClO浓度增大
C.H+浓度减小,HClO浓度增大 D.H+浓度增大,HClO浓度减小
查看答案和解析>>
科目:高中化学 来源:2016届山西省等校高三下第四次联考理综化学A卷(解析版) 题型:填空题
【化学—选修2:化学与技术】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如右图所示:
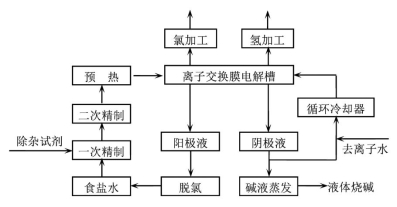
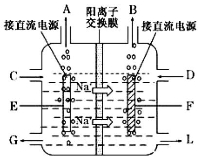
(1)该流程中可以循环的物质是 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO 等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。
等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。
①第一次精制过程中所加除杂试剂顺序不合理的是
A.BaCl2、NaOH、Na2CO3、HCl B.BaCl2、Na2CO3、NaOH、HCl
C.NaOH、BaCl2、Na2CO3、HCl D.Na2CO3、BaCl2、NaOH、HCl
②一次精制后的食盐水仍会有少量的Ca2+、Mg2+,需要送入阳离子交换塔进行二次精制,若不经过二次精制,直接进入离子膜电解槽,这样会产生什么后果 。
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成),则A处产生的气体是 ,F电极的名称是 。电解总反应的离子方程式为 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 。
(5)已知在电解槽中,每小时通过1 A的直流电理论上可以产生1.492 g的烧碱,某工厂用300个电解槽串联生产8 h,制得32%的烧碱溶液(密度为1.342 t/m3)113 m3,电解槽的电流强度1.45 ×104 A,该电解槽的电解效率为 (保留两位小数)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆兵团农二师华山中学高一下期中化学卷(解析版) 题型:选择题
下列化合物中,不能通过单质之间的反应直接制取的是
A.Fe3O4 B.FeCl3 C.FeCl2 D CuCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com