
| A、10 mL 0.2mol?L-1MgCl2溶液 |
| B、20 mL 0.5 mol?L-1 AgNO3溶液 |
| C、40 mL 0.3mol?L-1HCl溶液 |
| D、15 mL 0.1mol?L-1 AlCl3溶液 |


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
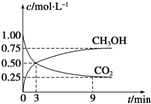 ①CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示.从3min到9min,v(H2)=
①CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示.从3min到9min,v(H2)=| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、碘易溶于酒精,因此可用酒精萃取碘水中的碘 |
| D、称量NaCl时,NaCl放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.13 mol |
| B、1 mol |
| C、1.05 mol |
| D、0.05 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 mL 0.4mol?L-1的盐酸 |
| B、10 mL 0.3mol?L-1 MgCl2溶液 |
| C、10 mL 0.5mol?L-1 NaCl溶液 |
| D、10 mL 0.1mol?L-1 AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、因为K的活泼性强,所以钾应该保存在煤油中 |
| B、K在空气可以燃烧,且产物是K2O |
| C、K 与水能够反应,但不如Na与水的反应剧烈 |
| D、K可以与水剧烈反应,生成氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com