
| A. | 将亚硫酸钠溶液在空气中蒸干、灼烧,得到的物质的主要成分是亚硫酸钠 | |
| B. | 硝酸亚铁溶液中加入一定量的盐酸可抑制Fe2+的水解,提高Fe2+的浓度 | |
| C. | 室温下OH-浓度相同的醋酸钠和碳酸钠的溶液加水稀释相同的倍数后,碳酸钠溶液的碱性弱 | |
| D. | 25℃,HCN的电离平衡常数Ka=5.0×10-10,同浓度的HCN和NaCN的混合溶液呈酸性 |
分析 A.亚硫酸钠具有还原性,易被空气中氧气氧化生成硫酸钠;
B.硝酸亚铁溶液中加入盐酸可以抑制硝酸亚铁水解,但会引入氯离子杂质;
C.根据越弱越水解的规律判断;
D.CN-水解平衡常数Kh=$\frac{Kw}{Ka}$计算后,比较HCN电离和CN-水解程度大小判断溶液酸碱性;
解答 解:A.亚硫酸钠具有还原性,易被空气中氧气氧化生成硫酸钠,将亚硫酸钠溶液在空气中蒸干、灼烧,得到的物质的主要成分是亚硫酸钠,故A错误;
B.硝酸亚铁溶液中加入一定量的盐酸可抑制Fe2+的水解,提高Fe2+的浓度,但溶液中引入新的杂质氯离子,故B错误;
C.加水促进盐类的水解,但碳酸根离子比醋酸根离子水解程度大,则碳酸钠溶液pH变化较大,碳酸钠溶液的碱性弱,故C正确;
D.25℃,HCN的电离平衡常数Ka=5.0×10-10,CN-+H2O?HCN+OH-,Kh=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{5.0×1{0}^{-10}}$=2×10-5mol>Ka,同浓度的HCN和NaCN的混合溶液中CN-水解程度大于HCN的电离程度,溶液呈碱性,故D错误;
故选C.
点评 本题考查了物质性质、溶液配制方法、盐类水解原理等,主要是水解平衡常数和弱电解质电离平衡常数的计算和溶液酸碱性的判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+ | |
| B. | 向某溶液中滴加稀盐酸,生成的无色无味气体能使澄清的石灰水变浑浊,则原溶液中一定含有CO32- | |
| C. | 加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO42- | |
| D. | 向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
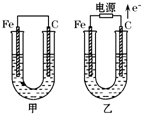 甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,两池中均为饱和NaCl溶液,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与溴水混合振荡,水层颜色变浅 | |
| B. | 乙炔与氢气反应变成乙烷 | |
| C. | 乙烯与水在一定条件下反应制取乙醇 | |
| D. | 乙烯与HCl在一定条件下反应制取氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-离子在该溶液中一定不能大量共存 | |
| B. | 该溶液的pH一定是13 | |
| C. | 向该溶液中加入铝片后,一定能生成氢气 | |
| D. | 若该溶液的溶质只有一种,它一定是酸或碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入适量铜粉除去Cu(NO3)2溶液中的Fe(NO3)3杂质 | |
| B. | 在物质提纯操作中不能用乙醇从碘水中萃取碘 | |
| C. | 向Ca(ClO)2溶液中通入CO2,溶液变浑浊,再加入品红溶液,红色褪去 | |
| D. | 向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
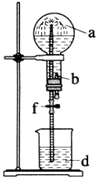 在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )| a(干燥气体) | b(液体) | |
| A | NO2 | 水 |
| B | CO2 | 水 |
| C | Cl2 | 饱和食盐水 |
| D | NH3 | 水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
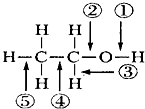
| A. | 在Cu催化作用下和O2反应时键①⑤断裂 | |
| B. | 和氢溴酸共热时键②断裂 | |
| C. | 和金属钠反应时键①断裂 | |
| D. | 和浓硫酸加热到170℃,键②⑤断裂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com