
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
I、经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
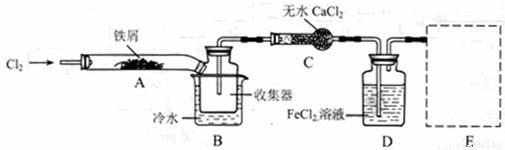
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(4)如果没有装置C的设计,会导致 。
(5)用离子方程式表示虚线框E中所增加装置和试剂的作用: 。
(6)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,
请写出反应的离子方程式: 。
Ⅱ、反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③ 。
为探究溶液的组成,实验如下:
|
实验步骤 |
实验现象 |
实验结论及反应离子方程式 |
|
①取少量所得溶液于试管中,加入少量KSCN溶液。 |
|
说明:假设②不成立,假设①或③成立;的离子方程式是 。 |
|
②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液。 |
溶液紫红色退去 |
说明: 。 |
综合上述实验分析,所得溶液中含有的金属阳离子有 。
Ⅰ、(1)2Fe+3Cl2  2FeCl3(2分)
2FeCl3(2分)
(2)用酒精灯对沉积在A右端的FeCl3加热(1分) (3)②⑤(2分)
(4)D装置中水挥发到接受器,使FeCl3潮解(2分)
(5)Cl2+2OH-=Cl-+ClO-+H2O (2分)
(6)2Fe3++2H2S=2Fe2++2 H++S↓(2分)
Ⅱ、③既有Fe3+又有Fe2+(1分)
|
实验步骤 |
实验现象 |
实验结论及反应离子方程式 |
|
|
溶液中出现红色。(1分) |
Fe3++3SCN-= Fe(SCN)3。(2分) |
|
|
|
假设②或③成立 |
Fe3+、Fe2+(1分)
【解析】
试题分析:(1)装置A中Fe与Cl2反应生成FeCl3,注意条件和配平可得2Fe+3Cl2  2FeCl3。
2FeCl3。
(2)要使沉积的FeCl3进入收集器,根据FeCl3加热易升华的性质,第④的操作应该是:在沉积的的FeCl3固体下方加热。
(3)装置干燥,通入的气体干燥均可防止其潮解,故步骤中②⑤合题意。
(4)装置C中CaCl2具有吸水性,可把D中挥发出的水分吸收,如果没有装置C,D装置中水挥发到接受器,使FeCl3潮解。
(5)虚线框E中盛放试剂为NaOH溶液,作用为吸收尾气中的Cl2,所以离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O。
(6)Fe3+具有氧化性,把H2S氧化为S,可写出离子方程式为:2Fe3++2H2S=2Fe2++2 H++S↓。
Ⅱ、根据①②可得③观点为既有Fe3+又有Fe2+;假设②不成立,假设①或③成立,说明溶液含有Fe3+,加入少量KSCN溶液,发生络合反应生成Fe(SCN)3,使溶液变为红色,离子方程式为:Fe3++3SCN-= Fe(SCN)3;加入少量酸性 KMnO4溶液,紫红色退去,说明溶液含有Fe2+,则假设②或③成立,所以溶液中含有的金属阳离子为Fe2+、Fe3+。
考点:本题考查化学方程式和离子方程式的书写、离子的推断、试剂与装置的作用、实验方案的分析。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:天津 题型:问答题
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
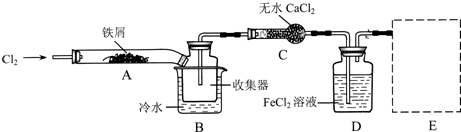
I.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检查装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成
④.。。。。。。。。
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封
请回答下列问题:
(1) 装置A中反应的化学方程式为——————
(2) 第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是——————
(3) 操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)——
(4) 装置B中的冷水作用为——————;装置C的名称为————;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:——
(5) 在虚线框内画出尾气吸收装置E并注明试剂
II.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6) FeCl3与H2S反应的离子方程式为——————————————————
(7) 电解池中H+再阴极放电产生H2,阳极的电极反应为————————
(8) 综合分析实验II的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;②——————————————————
查看答案和解析>>
科目:高中化学 来源:2013年全国普通高等学校招生统一考试理科综合能力测试化学(天津卷带解析) 题型:实验题
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业生产流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
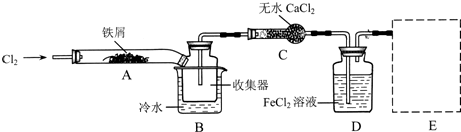
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检查装置的气密性;②通入干燥的Cl2,赶尽装置中的空气;③用酒精灯在铁屑下方加热至反应完成;④…… ⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A的右端。要使沉积得FeCl3进入收集器,第④步操作是 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(4)装置B中的冷水作用为 ;装置C的名称为 ;装置D中FeCl2全部反应完后,因为失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂: 。
(5)在虚线框内画出尾气吸收装置E并注明试剂
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为 。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应为 。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率100%;② 。
查看答案和解析>>
科目:高中化学 来源:2014届福建省高三上学期第三次月考化学试卷(解析版 题型:实验题
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
I、经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:

①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(3)如果没有装置C的设计,会导致
(4)用离子方程式表示虚线框E中所增加装置和试剂的作用: 。
(5)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,请写出反应的离子方程式: 。
Ⅱ、反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③ 。
为探究溶液的组成,实验如下:
|
实验步骤 |
实验现象 |
实验结论及反应离子方程式 |
|
①取少量所得溶液于试管中,加入少量KSCN溶液。 |
_________________。 |
说明:假设②不成立,假设①或③成立;反应的离子方程式是_____________。 |
|
②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液。 |
溶液紫红色退去 |
说明:________________________。 |
综合上述实验分析,所得溶液中含有的金属阳离子有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com