
【题目】如下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
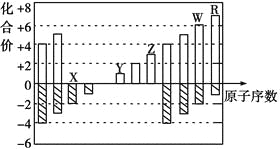
A.离子半径:Y>Z>X
B.气态氢化物的稳定性:R<W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
科目:高中化学 来源: 题型:
【题目】2020年3月11日注射用西维来司他钠获得国家药监局批准上市,用于治疗新冠病毒等造成的急性肺损伤,化合物F是合成该药物的中间体,其合成路线如下:
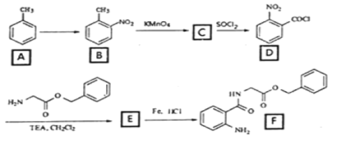
(1)E中官能团的名称是______;
(2)写出C的结构简式_______________;
(3)写出符合下列条件的B的一种同分异构体___________________;
①能发生水解反应且能发生银镜反应
②遇FeCl3溶液显蓝紫色
(4)反应A→B所需试剂及条件_________________;
(5)反应B→C的反应类型___________________;
(6)写出D→E的化学反应方程式_______________________;
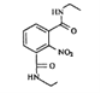
(7)参考本题信息,写出由间二甲苯与NH2CH2CH制备下图有机物的合成线路_________(无机试剂任选) 。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲烷燃料电池采用铂作电极催化剂,用KOH作为电池中的电解液,其工作原理的示意图如下:
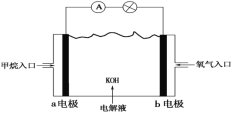
请回答下列问题:
(1)甲烷燃料电池的能量转化主要形式是__________________。
(2)Pt(a)电极是电池的________极,电极反应式为________________;Pt(b)电极发生________反应(填“氧化”或“还原”),电极反应式为________________。
(3)电池的总反应方程式为_______________________________。
(4)如果该电池工作时电路中通过4 mol电子,则消耗的CH4有________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向体积相同、浓度均为1 mol/L的HA、HB两种酸溶液中不断加水稀释,酸溶液的pH与酸溶液浓度的对数(lg C)间的关系如图。下列对该过程相关分析正确的是
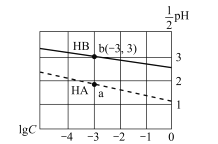
A. HB的电离常数(KA)数量级为10-3
B. 其钠盐的水解常数(Kh)大小关系是:NaB>NaA
C. a、b两点溶液中,水的电离程度b<a
D. 当lg C= -7时,两种酸溶液均有pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示渗透作用装置图,其中半透膜为膀胱膜,甲、丙装置中A、B、a、b溶液浓度分别用MA、MB、Ma、Mb表示,乙、丁装置分别表示一段时间后甲、丙装置的状态,液面上升的高度分别为h1、h2。如果A、B、a、b均为蔗糖溶液,且MA>MB,Ma=Mb>MA,则达到平衡后( )


A. h1>h2、Ma>MbB. h1>h2、Ma<Mb
C. h1<h2、Ma<MbD. h1<h2、Ma>Mb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示.则下列离子组在对应的溶液中一定能大量共存的是

A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. b点对应的溶液中:Al3+、Fe3+、NO3-、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中:Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙变红色的溶液:Na+、Cu2+、ClO-、Cl-
B. 0.1 mol·L-1 Na2CO3溶液:K+、AlO![]() 、Cl-、SO42-
、Cl-、SO42-
C. 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:H+、Al3+、Cl-、NO![]()
D. KW/c(H+)=0.1 mol·L-1的溶液中:Ca2+、NH4+、CH3COO-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛( HCHO)在化工、医药、农药等方面有着广泛的应用。
(1)甲醇脱氢法可制备甲醛,同时生成副产物CO等,已知以下热化学方程式:
CH3OH(1) ![]() HCHO(g) +H2(g) △H1= +129.8kJmol-1 (I)
HCHO(g) +H2(g) △H1= +129.8kJmol-1 (I)
CH3OH(g) ![]() CO(g) +2H2(g) △H2= +94.6kJmol-1(II)
CO(g) +2H2(g) △H2= +94.6kJmol-1(II)
CH3OH(1) ![]() CO(g) +2H2(g) △H3= +127.9 kJmol-1 (III)
CO(g) +2H2(g) △H3= +127.9 kJmol-1 (III)
①CH3OH(g) ![]() HCHO(g) +H2(g) △H4=_______kJmol-1(IV)
HCHO(g) +H2(g) △H4=_______kJmol-1(IV)
②650°C条件下,Na2CO3固体催化甲醇脱氢,是自由基引发的链反应,甲醇在Na2CO3表面上先吸附,然后发生分解,生成·H和·CH2OH或CH3O·自由基,自由基再从催化剂表面脱附、脱氢生成HCHO和CO,·H自由基相互结合成H2。已知:C—H键键能为413 kJ·mol-1;O—H键键能为463kJ·mol-1,试将可能性较大的转化过程补充完整:
CH3OH=·H+·CH2OH或CH3OH=·H + CH3O·;
_____=____+ HCHO;
________=3_______+ CO;
·H+·H=H2;
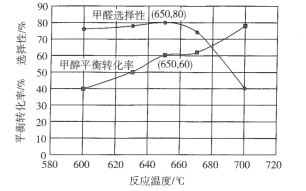
③反应温度对该反应的影响如图所示,从图中可以看出随着反应温度的升高,甲醇平衡转化率逐渐增加,这是因为__________;温度高于650℃,甲醛选择性迅速降低,原因是___________。按只发生反应( II )和( IV)两个平行反应,在650℃平衡时体系总压强为p,则该温度下反应(IV)的压强平衡常数Kp=__________(列出算式即可)。
(2)市售甲醛溶液含量的测定方法如下(已知:HCHOO+ H2O2=HCOOH + H2O、HCOOH + NaOH=HCOONa + H2O):
①向盛有10mL水的锥形瓶中滴入mg甲醛溶液样品,加过氧化氢溶液25mL(过量)与溴麝香草酚蓝指示液2滴,再加入1 molL-1氢氧化钠溶液25 mL,剩余的NaOH用1 molL-1盐酸滴定至溶液显黄色,消耗盐酸V1mL。
②空白实验:向盛有10mL水的锥形瓶中加过氧化氢溶液25mL与溴麝香草酚蓝指示液2滴,再加入1molL-1氢氧化钠溶液25mL,用1molL-1盐酸滴定至溶液显黄色,消耗盐酸V2mL。则甲醛溶液样品中甲醛的质量分数为______(用含m、V1、V2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的固定和转化是世界性课题。兰州大学最欢旺教授团队巧妙设计构建了系列新型光电催化人工光合成体系——光电催化池,p-n半导体异质结催化CO2在水中直接制备长碳链有机物并放出氧气,原理如下图:
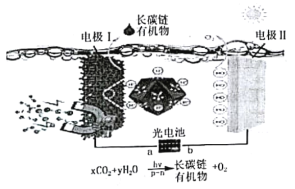
下列说法不正确的是
A.电极Ⅰ的电势比电极Ⅱ的电势高
B.该设计向大自然学习,模仿植物的光合作用
C.电子从a极流到电极I,从电极Ⅱ流到b极
D.负极区,p-n为催化剂,CO2发生还原反应生成长碳链有机物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com