
| A. | 气象环境报告中的“PM2.5”是对一种新分子的描述 | |
| B. | 长期使用硫酸铵(NH4)2SO4化肥会使土壤酸化 | |
| C. | “玉兔号”月球车太阳能电池帆板的材料是二氧化硅 | |
| D. | 高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应 |
分析 A.“PM2.5”为混合物;
B.硫酸铵(NH4)2SO4化肥显酸性;
C.太阳能电池帆板的材料是Si;
D.铝合金能与氧气反应.
解答 解:A.PM2.5颗粒直径小于2.5μm,不是新分子,为粒子聚合体,可导致雾霾的发生,故A错误;
B.硫酸铵(NH4)2SO4化肥显酸性,长期使用会使土壤酸化,故B正确;
C.因Si为半导体材料,太阳能电池帆板的材料是Si,故C错误;
D.铝合金能与氧气反应,但铝合金材料强度大、质量轻,故D错误;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应及性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 通入溴水通入澄清石灰水 | |
| B. | 点燃罩上涂有澄清石灰水的烧杯 | |
| C. | 点燃罩上干冷烧杯罩上涂有澄清石灰水的烧杯 | |
| D. | 点燃罩上涂有澄清石灰水的烧杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.Fe还原水体中NO3-的反应原理如图所示.
(1)用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一.Fe还原水体中NO3-的反应原理如图所示.| 化学键 | H-H | C-O | C-O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | 1075 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
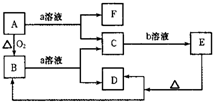 已知如图中A是固体单质,E是一种白色沉淀,F为密度最小的无色气体.且各种物质所含元素除H、O外,其余均为第三周期元素.
已知如图中A是固体单质,E是一种白色沉淀,F为密度最小的无色气体.且各种物质所含元素除H、O外,其余均为第三周期元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2mol SO2与足量O2反应可得到2mol SO3 | |
| B. | 含4mol HCl的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 | |
| C. | 10mL 18.0mol/L H2SO4与足量铜加热反应可制备0.09mol SO2 | |
| D. | 一定条件下,1mol N2与3mol H2反应可制备1.0 mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 碱性溶液中:Na+、ClO-、SO42-、I- | |
| C. | 0.1mol•L-1NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| D. | 0.1mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com