
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
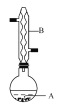
![]() +
+![]()
![]()
![]() +H2O
+H2O
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 水中溶解性 | |
异戊醇 | 88 | 0.812 3 | 131 | 微溶 |
乙酸 | 60 | 1.049 2 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.867 0 | 142 | 难溶 |
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片,开始缓慢加热A,回流50 min,反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液 和水 洗涤,分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯3.9 g。回答下列问题:
(1)仪器B的名称是________,它的作用是____________________。
(2)在洗涤操作中,第一次水洗的主要目是___________________________
第二次水洗的主要目的是_______________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后____(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是_____________________________。
(5)实验中加入少量无水MgSO4的目的是___________________________。
(6)在蒸馏操作中,仪器选择及安装都正确的是____(填标号)。
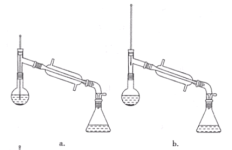
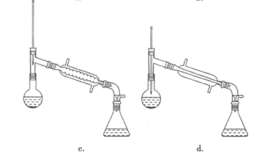
(7)本实验的产率是____(填标号)。
a.30% b.40% c. 60% d.90%
(8)在进行蒸馏操作时,若从130℃便开始收集馏分,会使实验的产率偏____(填“高”或“低”),其原因是____________________________________。
【答案】球形冷壁管 冷凝回流 除去硫酸和过量的乙酸 除去碳酸氢钠溶液 d 提高醇的转化率 干燥乙酸异戊酯 b c 高 会收集少量未反应的异戊醇
【解析】
在装置A中加入反应混合物和2~3片碎瓷片,开始缓慢加热A,利用冷凝管冷凝回流50分钟,反应液冷至室温后,倒入分液漏斗中,先用少量水洗掉大部分硫酸和醋酸,再用水洗涤碳酸氢钠溶液,分出的产物加入少量无水硫酸镁固体作干燥剂,静置片刻,过滤除去硫酸镁固体,进行蒸馏纯化,收集140~143℃馏分,得乙酸异戊酯,还考查了反应物转化率的提高方法,同时进行产率的计算有误差分析。
(1)由装置中仪器的结构可知,仪器B的名称为球形冷凝管,其作用是冷凝回流;
(2)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸和醋酸;第一步中饱和碳酸氢钠溶液既可以除去未洗净的醋酸,也可以降低酯的溶解度,但第一步洗涤后生成的酯中混有碳酸氢钠,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(3)由于酯的密度比水小,二者互不相溶,因此水在下层,酯在上层;分液时,要先将水层从分液漏斗的下口放出,待到两层液体界面时关闭分液漏斗的活塞,再将乙酸异戊酯从上口放出,所以正确的为d;
(4)酯化反应是可逆反应,增大反应物的浓度可以使平衡正向移动;增加一种反应物的浓度,可以使另一种反应物的转化率提高,因此本实验中加入过量乙酸的目的是提高转化率;
(5)实验中加入少量无水硫酸镁的目的是吸收酯中少量的水分,对乙酸异戊酯进行干燥;
(6)在蒸馏操作中,温度计的水银球要放在蒸馏烧瓶的支管口处,所以ad错误;c中使用的是球形冷凝管容易使产品滞留,不能全部收集到锥形瓶中,因此仪器及装置安装正确的是b;
(7)乙酸的物质的量为:n=![]() =0.1mol,异戊醇的物质的量为:n=
=0.1mol,异戊醇的物质的量为:n=![]() =0.05mol,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为=
=0.05mol,由于乙酸和异戊醇是按照1:1进行反应,所以乙酸过量,生成乙酸异戊酯的量要按照异戊醇的物质的量计算,即理论上生成0.05mol乙酸异戊酯;实际上生成的乙酸异戊酯的物质的量为=![]() =0.03mol,所以实验中乙酸异戊酯的产率为:
=0.03mol,所以实验中乙酸异戊酯的产率为:![]() ×100%=60%,故答案为:c;
×100%=60%,故答案为:c;
(8)在进行蒸馏操作时,若从130℃便开始收集馏分此时的蒸气中含有异戊醇,会收集少量的未反应的异戊醇,因此会导致产率偏高。


科目:高中化学 来源: 题型:
【题目】A~G是几种烃分子的球棍模型(如图),据此回答下列问题:
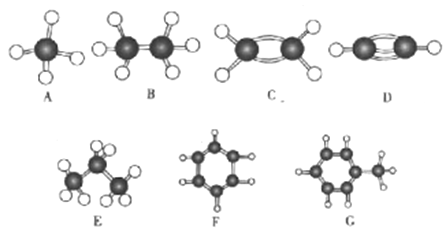
(1)常温下含氢质量分数最高的气态烃是______(填字母)。
(2)写出E失去一个氢原子后所得烃基的结构筒式:______________。
(3)一卤代物种类最多的是_______(填字母)。
(4)写出实验室制取D的化学方程式:________________。
(5)写出F发生硝化反应的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(变式探究)喷泉实验是中学化学的一个重要性质实验,也是一种自然现象。其产生原因是存在压强差。试根据下图,回答下列问题:

(1)图甲为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中盛有液体。下列组合中不可能形成喷泉的是________(填字母,下同。)
A.HCl和H2O B.O2和H2O
C.NH3和H2O D.CO2和NaOH溶液
(2)在图乙的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是________。
A.Cu与稀盐酸
B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸
D.NH4HCO3与稀盐酸
(3)在图乙的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质不可能是________。
A.浓硫酸 B.生石灰
C.硝酸铵 D.烧碱
(4)城市中常见的人造喷泉及火山爆发原理与上述________装置的原理相似。
(5)如果只提供如图丙(烧瓶内充满NH3)的装置,引发喷泉的方法是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
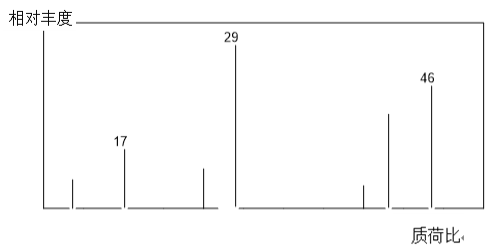
【题目】有机物A常用于食品行业,已知9.2 g A在足量的O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,二者分别增重3.6g和8.8 g,经检验剩余气体为O2。
(1)有机物A的质谱图如下图所示,从图中可知其相对分子质量是___。
(2)A的结构简式为___。
(3)用A进行下列反应
①银镜反应:A在进行银镜反应之前必须在其中加入一定量的_______,因为_______。
②A发生银镜反应的化学方程式为_____________。
③写出A和乙醇反应的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质硫在NaOH的热浓溶液中发生歧化反应,将2.56g硫与含0.0600molNaOH的热溶液反应恰好生成amolNa2Sx和bmolNa2S2O3,再加入1.00mol/L的NaClO溶液VmL,使溶液中所有硫元素全部转化为Na2SO4。计算:(1)a/b=________;
(2)V至少为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由天然气为原料制备甲醇,也可由水煤气合成甲醇.
![]() 已知:
已知:![]() ,
,![]() ,
,![]() 。试写出由
。试写出由![]() 和
和![]() 制取甲醇的热化学方程式:______;
制取甲醇的热化学方程式:______;
![]() 通过下列反应制备甲醇:
通过下列反应制备甲醇:![]() ,图甲是反应时
,图甲是反应时![]() 和
和![]() 的浓度随时间t的变化情况,从反应开始到平衡,用
的浓度随时间t的变化情况,从反应开始到平衡,用![]() 表示平均反应速率
表示平均反应速率![]() ______,平衡时CO的转化______.
______,平衡时CO的转化______.
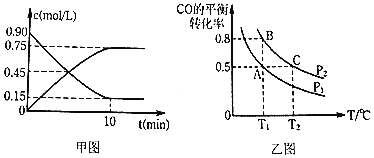
![]() 在一容积可变的密闭容器中充入
在一容积可变的密闭容器中充入![]() 和
和![]() ,CO的平衡转化率随温度
,CO的平衡转化率随温度![]() 、压强
、压强![]() 的变化如图乙所示.
的变化如图乙所示.
![]() 下列说法不能判断该反应达到化学平衡状态的是______
下列说法不能判断该反应达到化学平衡状态的是______![]() 填字母
填字母![]()
A ![]() 的消耗速率等于
的消耗速率等于![]() 的生成速率的2倍
的生成速率的2倍
B ![]() 的体积分数不再改变
的体积分数不再改变
C 体系中![]() 的转化率和CO的转化率相等
的转化率和CO的转化率相等
D 体系中气体的平均摩尔质量不再改变
![]() 比较A、B两点压强大小
比较A、B两点压强大小![]() ______
______![]() 填“
填“![]() 、
、![]() 、
、![]() ”
”![]()
![]() 若达到化学平衡状态A时,容器的体积为20L,如果反应开始时仍充入
若达到化学平衡状态A时,容器的体积为20L,如果反应开始时仍充入![]() 和
和![]() 2,则在平衡状态B时,容器的体积
2,则在平衡状态B时,容器的体积![]() ______L;
______L;
![]() 以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池
以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池![]() 电极材料为惰性电极
电极材料为惰性电极![]()
![]() 若KOH溶液足量,则电池负极反应的离子方程式为______;
若KOH溶液足量,则电池负极反应的离子方程式为______;
![]() 若电解质溶液中KOH的物质的量为
若电解质溶液中KOH的物质的量为![]() ,当有
,当有![]() 甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______.
甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积变化的曲线如图所示。据图判断正确的是 ( )
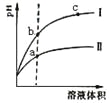
A.Ⅱ为盐酸稀释时pH变化曲线
B.a点Kw的数值比c点Kw的数值大
C.b点溶液的导电性比c点溶液的导电性强
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷在常温下是无色液体,密度是2.18g/cm3,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂.在实验室可用如图所示装置来制备1,2-二溴乙烷.其中试管c中装有浓溴水.
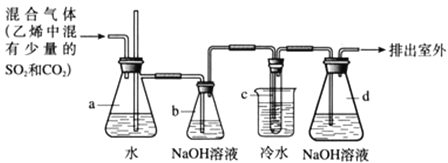
(1)写出制备1,2-二溴乙烷的化学方程式__________________________________;该反应属于______
反应(填反应类型);
(2)安全瓶a可以防止倒吸,并可以检查实验进行时试管c是否发生堵塞.如果发生堵塞,a中的现象是:____________________;
(3)容器b中NaOH溶液的作用是____________________;
(4)将试管c置于冷水中的目的是____________________;
(5)容器d中NaOH溶液的作用是____________________,所发生反应的离子方程式为
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com