
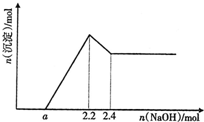
 现有SiO2、Fe2O3和Al2O3的混合物共42.2g,向其中加入2.0L一定浓度的盐酸,充分反应后过滤,再向滤液中滴加NaOH溶液.在滴加的过程中,产生沉淀的物质的量和加入NaOH的物质的量关系如图所示.求:
现有SiO2、Fe2O3和Al2O3的混合物共42.2g,向其中加入2.0L一定浓度的盐酸,充分反应后过滤,再向滤液中滴加NaOH溶液.在滴加的过程中,产生沉淀的物质的量和加入NaOH的物质的量关系如图所示.求:| n |
| V |
| 2.2mol |
| 2L |


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:阅读理解
 (2011?天河区一模)某铁矿石样品除含SiO2外,还含有FeO、Fe2O3中的一种或两种,某同学对铁的氧化物的成分进行探究.
(2011?天河区一模)某铁矿石样品除含SiO2外,还含有FeO、Fe2O3中的一种或两种,某同学对铁的氧化物的成分进行探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某铁矿石样品除含SiO2外,还含有FeO、Fe2O3中的一种或两种,某同学对铁的氧化物的成分进行探究.
某铁矿石样品除含SiO2外,还含有FeO、Fe2O3中的一种或两种,某同学对铁的氧化物的成分进行探究.查看答案和解析>>
科目:高中化学 来源:天河区一模 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2011年广东省广州市天河区高考化学一模试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com