
| m |
| M |
| m(总) |
| n(总) |
| n |
| v |
| 32 |
| 64 |
| 60g |
| 64g/mol |
| 15 |
| 16 |
| 40g |
| 32g/mol |
| 20 |
| 16 |
| ||
|
| 100 | ||||
|
| 45.71 |
| 32 |
| 10 |
| 7 |
| 10 |
| 7 |
| n |
| v |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、正极反应为4OH--4e-═O2↑+2H2O |
| B、放电时,CO32- 向负极移动 |
| C、电池供应1 mol水蒸气,转移的电子的物质的量为4 mol |
| D、放电时CO32-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
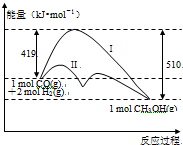 反应CO(g)+2H2(g)?CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )
反应CO(g)+2H2(g)?CH3OH(g)过程中的能量变化情况如图所示,曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况.下列判断正确的是( )| A、该反应的△H=+91 kJ/mol |
| B、加入催化剂,该反应的△H变小 |
| C、如果该反应生成液态CH3OH,则△H变大 |
| D、反应物的总能量大于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1 mol 甲基(-CH3)所含的电子数为 9NA |
| B、质子总数为 5NA的重水(D2O )物质的量是0.5 mol |
| C、0.1 mol Na2O2与水反应时,转移的电子数为 0.2NA |
| D、常温常压下,NA 个甲烷分子的体积大于 22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性氧化物 过氧化钠 Na2O2 |
| B、碱 纯碱 Na2CO3 |
| C、金属氧化物 氧化铁 FeO |
| D、非金属氧化物 三氧化硫 SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| V2O5 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯的结构简式:CH2CH2 |
| B、葡萄糖的结构式:C6H12O6 |
| C、1-丁烯的结构简式:CH2═CH-CH2CH3 |
| D、乙酸的实验式:C2H4O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com