
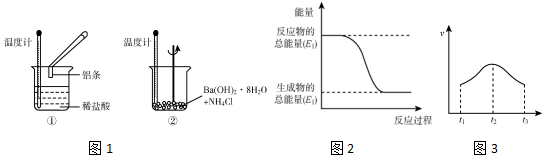
���� ��1����ѧ��Ӧ�У��¶����ߣ���Ӧ���ȣ��¶Ƚ�����Ӧ���ȣ�ͼ2�з�Ӧ���������������������������÷�ӦΪ���ȷ�Ӧ���ݴ˽��н��
��2���¶ȡ���Һ��������Ũ�ȶ�Ӱ�췴Ӧ���ʣ���ͽ������û���Ӧ�Ƿ��ȷ�Ӧ���൱����Һ�¶����ߣ������¶ȷ�Ӧ����������Ũ�Ⱥ��¶ȶԷ�Ӧ����Ӱ����Դ�С������
��3������Hԭ���غ���㷴Ӧ���������ʵ������ٸ���v=$\frac{\frac{��n}{V}}{��t}$�������ᷴӦ���ʣ�
��� �⣺��1��Al��HCl��Ӧ���¶����ߣ���˵����Ӧ���ȣ�Ba��OH��2•8H2O��NH4Cl�ķ�Ӧ�¶Ƚ��ͣ�˵����ӦΪ���ȷ�Ӧ��
��Ӧ��Ϊ���ȷ�Ӧ����Ӧ�������������������������������Ԣٵ������仯����ͼ2��ʾ��
�ʴ�Ϊ���ţ������٣�
��2���¶ȡ���Һ��������Ũ�ȶ�Ӱ�췴Ӧ���ʣ���ͽ������û���Ӧ�Ƿ��ȷ�Ӧ���൱����Һ�¶����ߣ������¶ȷ�Ӧ��������t1-t2ʱ���ڣ��¶������߶�������Ũ�����ͣ�������������˵����Ӧ���ʵ���ҪӰ���������¶ȣ�t2-t3������С��˵����Ӧ���ʵ���ҪӰ��������������Ũ�ȣ�
�ʴ�Ϊ��A��B��
��3��n��H2��=$\frac{0.224L}{22.4L/mol}$=0.01mol������Hԭ���غ�òμӷ�Ӧ��n��HCl��=2n��H2��=0.02mol�����ʱ����ڷ�Ӧ����v��HCl��=$\frac{\frac{0.02mol}{0.02L}}{2min}$=0.5mol/��L•min����
�ʴ�Ϊ��0.5��
���� ����������������ķ�ӦΪ���忼������ʵ�鷽����ƣ��漰��Ӧ���ʼ��㡢��Ӧ����Ӱ�����ص�֪ʶ�㣬Ϊ��Ƶ���㣬�ѵ��ǣ�2���������Ҫ�����¶ȡ�Ũ�ȶԷ�Ӧ�����ۺ�Ӱ�죬��Ŀ�ѶȲ���


 ��У��������ĩ��̾�ϵ�д�
��У��������ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Na2S��ȥ��ˮ�е�Hg2+ | B�� | ���ȵ�Na2CO3��Һȥ���� | ||
| C�� | ������֬��������Ӧ������� | D�� | ����CuSO4��Һʱ������ϡH2SO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
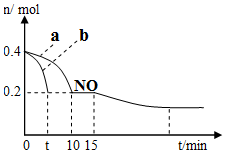 �о����֣�NOx��SO2����������Ҫ�ɷ֣���֪��
�о����֣�NOx��SO2����������Ҫ�ɷ֣���֪��| ��ѧʽ | H2CO3 | H2SO3 |
| ����ƽ�ⳣ�� | K1=4.30��10-7 K2=5.61��10-11 | K1=1.54��10-2 K2=1.02��10-7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
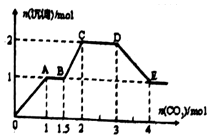 ��������ǿ����ʵĻ����Һ10L�����п��ܺ�K+��Ba2+��Na+��NH4+��Cl-��SO42-��AlO2-��OH-�еļ��֣�������ͨ��CO2���壬������������������CO2����֮�ʵĹ�ϵ��ͼ��ʾ������˵����ȷ���ǣ�������
��������ǿ����ʵĻ����Һ10L�����п��ܺ�K+��Ba2+��Na+��NH4+��Cl-��SO42-��AlO2-��OH-�еļ��֣�������ͨ��CO2���壬������������������CO2����֮�ʵĹ�ϵ��ͼ��ʾ������˵����ȷ���ǣ�������| A�� | ����Һ����ȷ�����ڵ�������Ba2+��Na+��Cl-��NH4+ | |
| B�� | �϶������ڵ�������Cl-��OH- | |
| C�� | ������ȷ�������������ٻ�����һ�������ӣ�������ӵ���СŨ��Ϊ��0.2mol/L | |
| D�� | OA�η�Ӧ�����ӷ���ʽ����2AlO2-+CO2+3H2O�T2Al��OH��3��+CO32- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
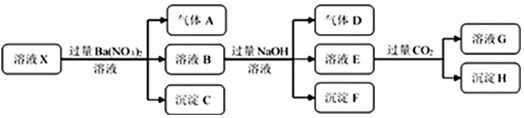
| A�� | ��Ҫȷ����ҺX���Ƿ���Fe3+�������Ϊȡ����ԭ��Һ���Թ��У���������KSCN��Һ����Һ��Ѫ��ɫ������Fe3+ | |
| B�� | ����CΪBaSO4������HΪBaCO3 | |
| C�� | ��Һ��һ������H+��Al3+��NH4+��Fe2+��SO42-��Cl- | |
| D�� | ����ҺXΪ100mL������������AΪ112mL�����������X��c��Fe2+��=0.05mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧ�� | H-H | N��N | N-H |
| ����/KJ•mol-1 | 436 | 946 | 390.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
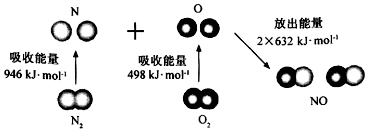
| A�� | ֱ�ۿ����÷�Ӧ�з�Ӧ�������е����������������������е������� | |
| B�� | 2 mol��̬��ԭ�ӽ������O2��g��ʱ���ܷų�498 KJ���� | |
| C�� | ����1 mol NO�����еĻ�ѧ������Ҫ����632KJ���� | |
| D�� | �÷�Ӧ���Ȼ�ѧ����ʽΪ��N2+O2�T2NO��H=+180KJ/mol�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
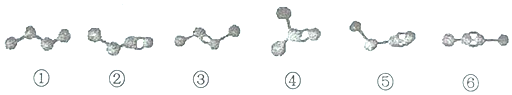
| A�� | ���ڡ��ۡ��ܵķ���ʽ��ΪC4H8������Ϊͬ���칹�� | |
| B�� | ���ݺ͢ķ���ʽ��ΪC4H6������Ϊͬ���칹�� | |
| C�� | ���ڡ��ۡ��ݡ��ֱ����������������ӳɷ�Ӧ�����ɵõ����� | |
| D�� | �����ʵ��������ں͢ݷֱ�����������ȫȼ�գ��������ĵ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������Ϊ8�ĵ�ԭ�ӣ�${\;}_{8}^{15}$N | |
| B�� | ������ĵ���ʽ��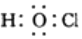 | |
| C�� | PCl5���ӵ�ÿ��ԭ�Ӷ�����8�����ȶ��ṹ | |
| D�� | �õ���ʽ��ʾNaCl���γɹ��̣�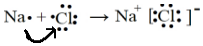 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com