
化学与生活、生产、环境等社会实际密切相关。下列叙述正确的是( )
A.稀的食盐水能杀死H7N9禽流感病毒
B.涤纶、塑料、光导纤维都是有机高分子材料
C.用电镀厂的废水直接灌溉农田,可提高水的利用率
D.外形似海绵、密度小、有磁性的碳与石墨互为同素异形体
 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
| 加入的物质 | 结论 | |
| A | 50mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO42-) |
| B | 0.05molCaO | 溶液中 |
| C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
| D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中粒子的物质的量浓度关系正确的是
A.0.1mol·L1NaHC2O4溶液与0.1mol·L1KOH溶液等体积混合,所得溶液中:
c(Na)>c(K)>c(C2O42)>c(OH)>c(HC2O4)
B.20mL 0.1 mol·L1NH4Cl溶液与10mL 0.1mol·L1NaOH溶液混合后溶液呈碱性,所得溶液中:c(Cl)>c(NH4+)>c(Na)>c(OH)>c(H)
C.常温下,pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中:
c(Na)+c(OH)>c(H)+c(F)
D.0.1mol·L1NH3·H2O溶液与0.1mol·L1HNO3等体积混合,所得溶液中:
c(H)>c(OH)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化锰在生产、生活中有广泛应用。
(1)锌—锰碱性电池广泛应用于日常生活。电池的总反应式为
Zn(s)+2MnO2(s)+2H2O(l)===Zn(OH)2(s)+2MnOOH(s)。
该电池的正极反应式为 。
(2)某学习小组拟以废旧干电池为原料制取锰,简易流程如下:
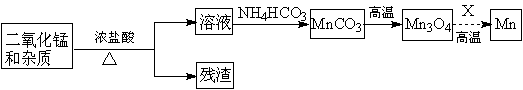
①加入浓盐酸溶于废旧电池内黑色物质过程中保持通风,其原因是 。
②从产品纯度、环保等角度考虑,X宜选择 (填代号)。
A.焦炭 B.铝 C.氢气 D.一氧化碳
③写出碳酸锰在空气中灼烧生成四氧化三锰的化学方程式 。
(3)电解硫酸锰溶液法制锰又叫湿法冶锰。以菱锰矿(主要成份是MnCO3,主要杂质是Fe2+、Co2+、Ni2+)为原料制备锰的工艺流程如下:
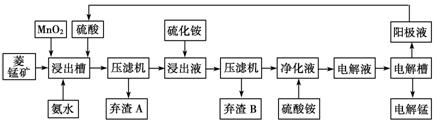
已知:NiS 、CoS均难溶于水。部分氢氧化物的pH如下表:(若某离子浓度小于等于105mol·L1,则认为完全沉淀)
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
①用离子方程式表示加入二氧化锰的作用 。
②加入氨水调节浸出槽中溶液的pH范围: 。
③弃渣B可能含有的物质为 。
④电解槽阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【定量实验设计】某研究性学习小组查阅资料获得晶体M的制备原理,他们进行如下探究:
【制备晶体】
以CrCl2•4H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了晶体M。
(1)溶液中分离出晶体M的操作包括蒸发浓缩、冷却结晶、过滤、洗涤和干燥。
他们用冰水和饱和食盐水的混合物洗涤晶体M,其目的是 。
制备过程中需要加热,但是,温度过高造成的后果是 。
【测定组成】
为了测定M晶体组成,他们设计如下实验。装置如图所示(加热仪器和固定仪器省略)。
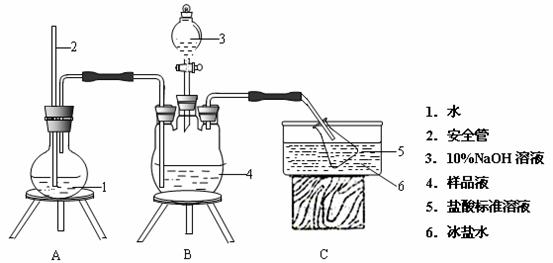
为确定其组成,进行如下实验:
①氨的测定:精确称M晶体,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量20% NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用一定量的盐酸溶液吸收。蒸氨结束后取下接收瓶,用一定浓度的NaOH标准溶液滴定过剩的HCl,到终点时消耗一定体积的 NaOH溶液。
②氯的测定:准确称取a g样品M溶于蒸馏水,配成100 mL溶液。量取25.00 mL配制的溶液用c mol·L1AgNO3标准溶液滴定,滴加3滴0.01 mol·L1K2CrO4溶液(作指示剂),至出现砖红色沉淀不再消失为终点(Ag2CrO4为砖红色),消耗AgNO3溶液为b mL。
(2)安全管的作用是 。
(3)用氢氧化钠标准溶液滴定过量的氯化氢,部分操作步骤是检查滴定管是否漏液、用蒸馏水洗涤、 、排滴定管尖嘴的气泡、 、滴定、读数、记录并处理数据;下列操作或情况会使测定样品中NH3的质量分数偏高的是 (填代号)。
A.装置气密性不好 B.用酚酞作指示剂
C.滴定终点时俯视读数 D.滴定时NaOH溶液外溅
(4)已知:硝酸银热稳定性差;Ksp(Ag2CrO4)=1.12×1012,Ksp(AgCl)=1.8×1010
选择棕色滴定管盛装标准浓度的硝酸银溶液,滴定终点时,若溶液中
c(CrO42)为2.8×103 mol·L1,则c(Ag+)= 。
(5)根据上述实验数据,列出样品M中氯元素质量分数计算式 。
如果滴加K2CrO4溶液过多,测得结果会 (填:偏高、偏低或无影响)。
(6)经测定,晶体M中铬、氨和氯的质量之比为104∶136∶213。写出制备M晶体的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与人类生活、环境保护、能源开发、资源利用等密切相关。下列说法不正确的是( )
A.在食用盐中添加适量的碘单质
B.用聚氯乙烯塑料袋包装食品
C.在食品加工中科学使用食品添加剂
D.研发高效低毒的农药,降低蔬菜的农药残留量
查看答案和解析>>
科目:高中化学 来源: 题型:
用试纸检验气体性质是一种重要的实验方法。如图所示的实验中(可加热),下列试纸的选用、现象及对应结论都正确的一项是( )
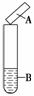
| 选项 | 试剂B | 湿润的试纸A | 现象 | 结论 |
| A | 碘水 | 淀粉试纸 | 变蓝 | 碘具有氧化性 |
| B | 浓氨水,生石灰 | 蓝色石蕊试纸 | 变红 | 氨气为碱性气体 |
| C | Na2SO3,硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
| D | Cu,浓硝酸 | 淀粉KI试纸 | 变蓝 | NO2为酸性气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为:该溶液pH升高的原因是HCO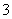 的水解程度增大,碱性增强。
的水解程度增大,碱性增强。
乙同学认为:该溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________NaHCO3的水解程度(填“大于”或“小于”)。
丙同学认为甲、乙的判断都不充分。
丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则________(填“甲”或“乙”)的判断正确。试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液
C.NaOH溶液 D.澄清石灰水
(2)将加热煮沸后的溶液冷却到10 ℃,若溶液的pH________8.3(填“高于”、“低于”或“等于”),则________(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150 ℃,丙断言________(填“甲”或“乙”)判断是错误的,理由是__________________________________ _______________________________________________________________。
(4)关于NaHCO3饱和水溶液的表述正确的是_______________________。
a.c(Na+)=c(HCO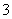 )+c(CO
)+c(CO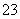 )+c(H2CO3)
)+c(H2CO3)
b.c(Na+)+c(H+)=c(HCO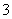 )+c(CO
)+c(CO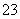 )+c(OH-)
)+c(OH-)
c.HCO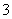 的电离程度大于HCO
的电离程度大于HCO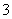 的水解程度
的水解程度
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是( )
A.第一电离能:④>③>②>①
B.原子半径:④>③>②>①
C.电负性:④>③>②>①
D.最高正化合价④>③=②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com