
 锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.
锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.分析 (1)活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,分子晶体中存在范德华力,金属晶体中存在金属键;
(2)SOCl2中O元素为-2价、Cl元素为-1价,根据化合价的代数和为0确定S元素化合价;1个SOCl2中的σ键数目是3,元素非金属性越强,其电负性越大;
(3)Fe是26号元素,其原子核外有26个电子,Fe原子失去最外层2个电子生成Fe2+,其3d能级上5个电子为其价电子;配位键由含有孤电子对的原子指向含有空轨道的原子;
(4)锂键应该是Li原子和F原子形成的分子间作用力.
解答 解:(1)活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,分子晶体中存在范德华力,金属晶体中存在金属键,
该反应中Li中存在金属键,SOCl2和SO2中存在极性键和范德华力,S中存在非极性键和范德华力,LiCl中存在离子键,所以只有氢键不存在,故选c;
(2)SOCl2中O元素为-2价、Cl元素为-1价,根据化合价的代数和为0确定S元素化合价为+4价;1个SOCl2中的σ键数目是3,所以1molSOCl2中的σ键数目是3NA;元素非金属性越强,其电负性越大,这几种元素电负性大小顺序是O>Cl>S,
故答案为:+4;3NA;O>Cl>S;
(3)Fe是26号元素,其原子核外有26个电子,Fe原子失去最外层2个电子生成Fe2+,其3d能级上5个电子为其价电子,则其价电子排布式为3d6;配位键由含有孤电子对的原子指向含有空轨道的原子,配位键表示为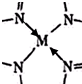 ,故答案为:3d6;
,故答案为:3d6; ;
;
(4)锂键应该是Li原子和F原子形成的分子间作用力,故选b.
点评 本题考查物质结构和性质,为高频考点,涉及配位键、锂键、电负性、原子核外电子排布等知识点,难点是配位键表示方法,(4)题以氢键为例采用知识迁移方法解答,注意配位键属于共价键、氢键属于分子间作用力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将饱和FeCl3溶液滴入沸水中 | 溶液变红褐色 | 有Fe(OH)3生成 |
| B | 向Na2S溶液中滴加盐酸 | 产生气泡 | Cl的非金属性比S强 |
| C | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中含有SO42- |
| D | 用导线连接铜片和锌片后插进盐酸中 | 铜片上有气泡 | 铜片是原电池的正极 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
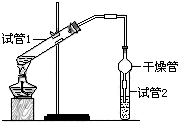 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.为证明浓硫酸在实| 实验 编号 | 试管1中的试剂 | 试管2中试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 饱和碳酸钠溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
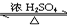 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
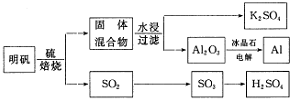
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
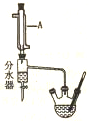 实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.CH3COOH+CH3CH3CH2CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH2CH2CH3+H2O有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度g.cm-3 | 沸点/ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④①③ | B. | ②①④③ | C. | ①②③④ | D. | ①②④③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com