
【题目】下列化合物中,既有离子键又有共价键的是( )
A.CaCl2
B.MgO
C.HNO3
D.NH4Cl
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的表示及说法正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+ ![]() H2SO4 (aq)=NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol
H2SO4 (aq)=NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol
C.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定
D.已知I2(g)+H2(g)=2HI(g)△H1<0;I2(s)+H2(g)=2HI(g )△H2<0,则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
化学反应 | 平衡 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g)CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g)CH3OH(g)+H2O(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示).500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(molL﹣1)分别为0.8、0.1、0.3、0.15,则此时v正v逆(填“>”、“=”或“<”).
(2)对于反应③,在相同温度和容积不变时,能说明该反应已达平衡状态的是
A.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3:1
D.容器内的密度保持不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数之和为45,四种元素均位于不同主族。a的最高正价和最低负价代数和等于0;b单质可作半导体材料;d的气态氢化物与其最高价含氧酸都是强酸。下列说法正确的是
A. 四种元素中b的非金属性最强 B. 原子半径:c>b
C. 最简单氢化物的稳定性:b>d D. 化合物bad3中存在离子键和极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是
A. 周期表里主族元素所在的族序数等于原子核外电子数
B. 周期表里元素所在的周期序数等于原子核外电子层数
C. 元素周期表有7个主族,7个副族,1个0族,1个第Ⅷ族,共16纵行
D. X2+的核外电子数目为18,则X在第四周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是红黄色有毒气体,有刺激性气味,沸点为11℃,极易溶于水但不与水反应,遇热水缓慢水解成次氯酸、氯气和氧气,见光也易分解,因此其溶液置于冷暗处相对稳定。某校合作学习小组的同学欲制备二氧化氯水溶液并检验其性质。
Ⅰ.二氧化氯水溶液制备。
向圆底烧瓶中先加入10gKClO3固体和9gH2C2O4·2H2O(草酸),然后再加入5mL稀硫酸,用磁力搅拌器搅拌(如下图);将烧瓶放在热水浴中,保持水浴温度在60~80℃,至B中广口瓶内溶液呈深红黄色时停止加热。
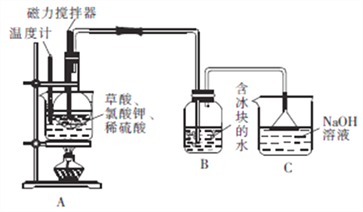
回答下列问题:
(1)装置A用水浴加热的优点是_________________;装置A中水浴温度不宜低于60℃也不宜高于80℃,其原因是______________________。
(2)装置A中反应生成ClO2及KHSO4等产物的化学方程式为_________________。
(3)装置B的水中需放入冰块的目的是_________________,装置C的作用是_______________
Ⅱ.设计实验验证ClO2的氧化性。
(4)取适量ClO2水溶液加入H2S溶液中,振荡,得无色溶液。欲检验H2S的氧化产物,还需要用到的试剂是_______________________。
(5)证明ClO2的氧化性比Fe3+强的方案是______________________。
(6)将少量ClO2水溶液滴入盛有MnSO4溶液的试管中,振荡,有黑色沉淀生成,则该反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中:2A(g)+B(g)![]() 2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量是( )
A. 3.4 mol B. 3.2 mol C. 2.8 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,也是一种植物生长调节剂,在生产生活中有重要应用。下列有关乙烯及其工业产品乙醇的性质及应用,请作答。
(1)将乙烯气体通入溴的四氯化碳溶液中,反应的化学方程式为_______________________;
(2)下列各组化学反应中,反应原理相同的是___________(填序号);
①乙烯使溴的四氯化碳溶液褪色和乙烯使酸性KMnO4溶液褪色
②苯与液溴在催化剂作用下的反应和乙醇使酸性KMnO4溶液褪色
③甲烷光照条件下与氯气反应和苯与硝酸在浓硫酸条件下反应
(3)取等物质的量的乙醇和乙烯,在足量的氧气中完全燃烧,两者耗氧量的关系乙醇___________乙烯(填大于、小于、等于);
(4)工业上可由乙烯水合法生产乙醇,乙烯水合法可分为两步(H2SO4可以看作HOSO3H)
第一步:反应CH2=CH2+HOSO3H(浓硫酸)→CH3CH2OSO3H(硫酸氢乙酯);
第二步:硫酸氢乙酯水解生成乙醇。
①第一步属于___________(填反应类型)反应;
②上述整个过程中浓硫酸的作用是___________(填选项)
A.氧化剂 B.催化剂 C.还原剂
(5)发酵法制乙醇,植物秸秆(含50%纤维素)为原料经以下转化制得乙醇
植物秸秆![]() C6H12O6
C6H12O6![]() 2CH3CH2OH+2CO2↑
2CH3CH2OH+2CO2↑
现要制取2.3吨乙醇,至少需要植物秸秆___________吨。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com