
|
3.6 g CO和H2组成的混合气体与足量氧气充分燃烧后,立即将全部燃烧产物通过足量Na2O2固体,固体质量增加 | |
| [ ] | |
A. |
2.1 g |
B. |
3.6 g |
C. |
7.2 g |
D. |
8.4 g |
科目:高中化学 来源: 题型:阅读理解
 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
| ||
| ||
1.2V×
| ||
|
1.2V×
| ||
|
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
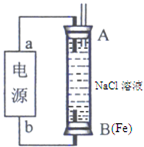 (2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
(2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?泰安一模)研究碳及其化合物的性质对促进低碳社会的构建具有重要意义.
(2013?泰安一模)研究碳及其化合物的性质对促进低碳社会的构建具有重要意义.| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
查看答案和解析>>
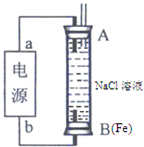
科目:高中化学 来源:济南一模 题型:问答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇(CH3OH)是一种重要的化工原料,合成甲醇的主要反应为:
CO(g)+2H2(g)![]() CH3OH(g) ΔH < 0。
CH3OH(g) ΔH < 0。
原料气的加工过程中常常混有一定量CO2,为了研究不同温度下CO2对该反应的影响,以CO2、CO和H2的混合气体为原料在一定条件下进行实验,结果表明,原料气各组分含量不同时,反应生成甲醇和副产物甲烷的碳转化率是不相同的。实验数据见下表:
| CO2%-CO%- H2% (体积分数) | 03070 | 22870 | 42670 | 82270 | 201070 | |||||||||||
| 反应温度/℃ | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | 225 | 235 | 250 | |
| 碳转 化率 (%) | CH3OH | 4.9 | 8.8 | 11.0 | 36.5 | 50.7 | 68.3 | 19.0 | 33.1 | 56.5 | 17.7 | 33.4 | 54.4 | 8.0 | 12.0 | 22.6 |
| CH4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 2.8 | 2.8 | 2.8 | |
(1)由上表数据可得出多个结论。
结论一:在一定条件下,反应温度越高,碳转化率__________。
结论二:___________________________________________________________
____________________________________________________________________。
为了验证结论二,有科学家又用以下五组不同组成的原料气再次进行实验。
| 组别 | 体积分数(%) | |||
| CO | CO2 | H2 | N2 | |
| 第1组 | 19.7 | 0.0 | 59.1 | 21.2 |
| 第2组 | 20.7 | 0.3 | 62.1 | 16.9 |
| 第3组 | 16.9 | 1.3 | 50.7 | 31.1 |
| 第4组 | 19.8 | 5.5 | 59.4 | 15.3 |
| 第5组 | 20.3 | 10.9 | 60.9 | 7.9 |
进行该验证实验时,控制不变的因素有________________、_________________、__________
__________________________________等。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com