
| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| C. | 用氨水溶液氯化银沉淀:Ag++2NH3•H2O═[Ag(NH3)2]++2H20 | |
| D. | Fe(OH)3 溶于过量的HI溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
分析 A.原子个数不守恒;
B.漏掉氢离子与氢氧根离子的反应;
C.氯化银为沉淀,保留化学式;
D.三价铁离子具有强的氧化性,能够氧化碘离子生成单质碘.
解答 解:A.钠与水反应离子方程式:2Na+2H2O═2Na++2OH-+H2↑,故 A错误;
B.硫酸溶液与氢氧化钡溶液反应的离子方程式为Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓,故B错误;
C.用氨水溶解氯化银沉淀,氯化银不能拆开,正确的离子方程式为:AgCl+2NH3•H2O=[Ag(NH3)2]++2H2O+Cl-,故C错误;
D.Fe(OH)3 溶于过量的HI溶液,离子方程式:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O,故D正确.
故选:D.
点评 本题考查了离子方程式的书写判断,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,注意离子反应遵循客观事实、原子个数守恒、电荷守恒规律,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | (1)(3) | B. | (1)(4) | C. | (2)(3) | D. | (2)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
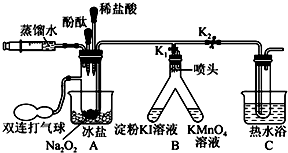
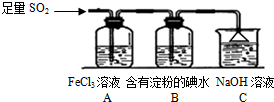 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅可用于制造光导纤维 | B. | 氯氧化钠用来治疗胃酸过多 | ||
| C. | 铝制容器可以用来贮运稀硝酸 | D. | 乙烯用作水果的催熟剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
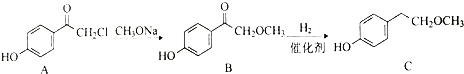
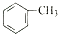 ;b.CH≡CCH3; c、
;b.CH≡CCH3; c、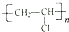
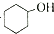 和
和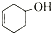 ,可选用b(填字母)
,可选用b(填字母)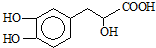
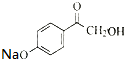
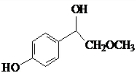
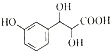 )与足量溴水反应所得产物的结构简式为
)与足量溴水反应所得产物的结构简式为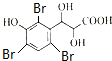 .
.
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | H2S的沸点比H2O的高 | H2S的范德华力大于H2O的范德华力 |
| B | 白磷为正四面体分子 | 白磷分子中P-P-P的键角是109.5° |
| C | 1体积水可以溶解700体积氨气 | 氨是极性分子且有氢键的影响 |
| D | 键的极性:H-O>N-H | 非金属性差异越大,键的极性越小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
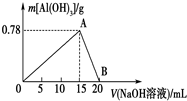 向20mL某物质的量浓度的AlCl3溶液中滴入2mol•L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向20mL某物质的量浓度的AlCl3溶液中滴入2mol•L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com