


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
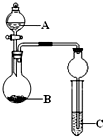 用下列几个实验,可快速制取实验室所需的少量气体,并进行相关性质实验.(实验装置如图所示)
用下列几个实验,可快速制取实验室所需的少量气体,并进行相关性质实验.(实验装置如图所示)查看答案和解析>>
科目:高中化学 来源:郑州国华学校2009-2010年高三上学期第一次月考化学试题 题型:058
已知氧化性:KMnO4>HNO3;Bi位于周期表中ⅤA族,+3价较稳定,NaBiO3溶液为无色.取一定量的酸性Mn(NO3)2溶液依次进行下列实验,现象记录如下.
①滴加适量的NaBiO3溶液,溶液变为紫红色.
②继续滴加适量H2O2,紫红色褪去,并有气泡产生.
③再加适量的PbO2固体,固体溶解,溶液又变为紫红色.
④最后通入足量的SO2气体,请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________;
(2)实验④中的现象为________;
(3)实验②的离子方程式是:________.
实验③的离子方程式是________.
查看答案和解析>>
科目:高中化学 来源:2009-2010学年河南省郑州市国华学校高三(上)第一次月考化学试卷(解析版) 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com