
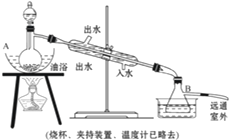
(14��) ��ͼ��ʾ��һ����ȡCl2����Cl2Ϊԭ�Ͻ����ض���Ӧ��װ�ã����и��Լ�ƿ��װ�Լ�Ϊ��B(Na2S)��C(FeBr2)��D(����-KI)��E(SO2��BaCl2)��F(ˮ)��H(��ɫʯ��)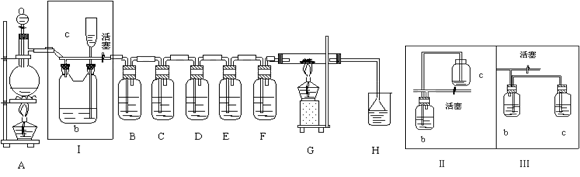
(1)д��ʵ������ȡCl2�Ļ�ѧ����ʽ___________________________________________________________
(2)����bƿ�ڼ����Һ���� ��װ�â�����ͼ�е�װ��_______(����)����
(3)ʵ�鿪ʼʱ���ȵ�ȼA���ƾ��ƣ���Һ©�������͢�������Cl2��������װ�ã��ٵ�ȼG���ƾ��ƣ��ش��������⣺
������װ���е�������B _________________��D _______________________ __
��д��E�з�Ӧ�����ӷ���ʽ��
_____________________________________��________________________________________
(4)G��Ӳ�ʲ�������ʢ��̼�ۣ���Ӧ��IJ���ΪCO2��HCl��д��G�еķ�Ӧ�Ļ�ѧ����ʽ__________
(5)��H������ɫʯ����Һ����ɫ����ɫ��Ϊ��ɫ���ٱ�Ϊ��ɫ����ԭ����__________________________
(14��) ��1��MnO2��4HCl(Ũ) MnCl2��H2O��Cl2�� ��2������ʳ��ˮ ��
MnCl2��H2O��Cl2�� ��2������ʳ��ˮ ��
��3������dz��ɫ�������ɣ���Һ����
��Cl2��SO2��2H2O=4H+��SO42-��2Cl- Ba2+��SO42-=BaSO4��
��4�� C��2H2O��2Cl2 CO2����4HCl��
CO2����4HCl��
��5��Cl2��H2O��Ӧ���ɵ�HClʹ��ɫʯ����Һ���ɫ��ʣ���Cl2����ˮ��������HClO������Ư�����ã�ʹ��ɫ��ȥ
���������������1��ʵ������ȡ�����ķ���ʽ��MnO2��4HCl(Ũ) MnCl2��H2O��Cl2����
MnCl2��H2O��Cl2����
��2������Ũ������лӷ��ԣ��������ɵ������к����Ȼ������壬����bƿ�ڼ����Һ���DZ���ʳ��ˮ��Ŀ���dz�ȥ�����е��Ȼ������塣װ�â����������ȫƿ�����ã����Ի�������ͼ�е�װ��Ӧ���Ǣ�
��3������������ǿ�����ԣ��������������ɵ���S������B����dz��ɫ�������ɣ������ܰѵ⻯���������ɵ��ʵ⣬��������������ɫ��
�����������ܰ�SO2�����������ᣬ�����������ᱵ��ɫ����������E�з�Ӧ�����ӷ���ʽ��Cl2��SO2��2H2O=4H+��SO42-��2Cl-��Ba2+��SO42-=BaSO4����
��4�������������֪����ˮ�μӣ����Է�Ӧ�ķ���ʽ��C��2H2O��2Cl2 CO2����4HCl����
CO2����4HCl����
��5������Cl2��H2O��Ӧ���ɵ�HClʹ��ɫʯ����Һ���ɫ��ʣ���Cl2����ˮ��������HClO������Ư�����ã�����ʹ��ɫ��ȥ��
���㣺������������ȡ�����ʡ�β�������Լ�����ʽ����д��
��������ѧ��һ����ʵ��Ϊ������ѧ�ƣ������л�ѧʵ�鼴��ѧ̽��֮˵�����ݹ۽�����߿�����Ҫ�Կ���̽����ʵ��������Ʊ�ʵ��Ϊ������Щ̽���Ժ��Ʊ���ʵ������⣬�ۺ���ǿ�����ۺ�ʵ������ϵ���ܣ��еĻ��ṩһЩ�µ���Ϣ��Ҫ���������侲�����⣬��ϵ��ѧ����֪ʶ�ͼ��ܣ�����֪ʶ����ȡ�Ǩ�ơ����飬ȫ��ϸ�µ�˼��������ȷ����


 ������ȫ��������ϵ�д�
������ȫ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
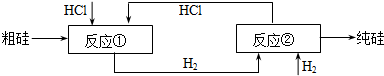
| ||
| ||
�鿴�𰸺ͽ���>>
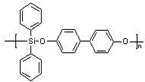
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ũ���� |
| �� |
| Ũ���� |
| �� |




| ���� |
| �� |
 +��n-1��H2O
+��n-1��H2O
| ���� |
| �� |
 +��n-1��H2O
+��n-1��H2O ��
�� ��
��
 ��
�� ��
��


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
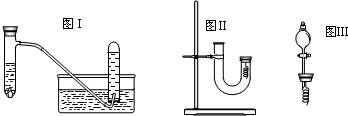
| ʵ�鲽�� | ���� |
| 1��U����˼���ϡ����ֱ������U���Ҷ� | ��/ |
| 2�ø���ͭ˿�Ľ�����סU���Ҷˣ��۲����� | ������ ����ɫ����������ұ���Һ�����ɫ ����ɫ����������ұ���Һ�����ɫ |
| 3����Ӧֹͣ��������۲�ʵ������ | ������ ��ɫ����������Ӵ���������ɺ���ɫ ��ɫ����������Ӵ���������ɺ���ɫ |
| 10-3a�qV +0.5 |
| 0.14 |
| 10-3a�qV +0.5 |
| 0.14 |
| 1 |
| 2 |
|
|
| 1 |
| 2 |
|
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������������ɫ����ˮ����ζ��Һ�壬�е�77.2�棬ijͬѧ��ȡ���ñ�����14.3mL��95%���Ҵ� 23mL�����õ�Ũ���ᡢ����̼�����Լ��������Ҵ���ϳ���ˮ������Ȼ�����Һ����Ҫ������ͼ��ʾ��
������������ɫ����ˮ����ζ��Һ�壬�е�77.2�棬ijͬѧ��ȡ���ñ�����14.3mL��95%���Ҵ� 23mL�����õ�Ũ���ᡢ����̼�����Լ��������Ҵ���ϳ���ˮ������Ȼ�����Һ����Ҫ������ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 17��
17��
���綫������������14�֣���ͼ��ʾ������Ϊ�ʵ�������A��B��C�������Ϊ300����L=2m�Ĺ̶�б���ϣ������б���Ķ�Ħ����������![]() ��A��B������һ��C�����ڹ̶������ϣ������������ֱ�ΪmA��0.80kg��mB��0.64kg��mC��0.50kg������A�����磬B��C�Ĵ������ֱ�ΪqB����4.0��10-5C��qC����2.0��10-5C�ұ��ֲ��䣬��ʼʱ���������ܱ��־�ֹ����б������Ħ�������ã����ѡ�����������������Զ���ĵ�����Ϊ0�������Ϊrʱ�������ɾ��еĵ����ܿɱ�ʾΪ
��A��B������һ��C�����ڹ̶������ϣ������������ֱ�ΪmA��0.80kg��mB��0.64kg��mC��0.50kg������A�����磬B��C�Ĵ������ֱ�ΪqB����4.0��10-5C��qC����2.0��10-5C�ұ��ֲ��䣬��ʼʱ���������ܱ��־�ֹ����б������Ħ�������ã����ѡ�����������������Զ���ĵ�����Ϊ0�������Ϊrʱ�������ɾ��еĵ����ܿɱ�ʾΪ![]() ���ָ�Aʩ��һƽ����б�����ϵ���F��ʹA��б���������ٶ�a��1.5m/s2���ȼ���ֱ���˶�������ʱ��t0����F��Ϊ��������A�˶���б�涥��ʱ��ȥ��F����֪����������k��9.0��109N?m2��C2��g��10m/s2����
���ָ�Aʩ��һƽ����б�����ϵ���F��ʹA��б���������ٶ�a��1.5m/s2���ȼ���ֱ���˶�������ʱ��t0����F��Ϊ��������A�˶���б�涥��ʱ��ȥ��F����֪����������k��9.0��109N?m2��C2��g��10m/s2����
��1��δʩ����Fʱ���B��C��ľ��룻
��2��t0ʱ����A�ϻ��ľ��룻
��3��t0ʱ���ڿ��������Ĺ���
��4����F��A��������ܹ���
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com