
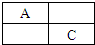
 A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素.
A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素. ,故答案为:
,故答案为: ;
;| 6.72L |
| 22.4L/mol |
| 0.1L×8mol/L-0.3mol |
| 2 |
| 10 |
| 3 |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| A、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、变质的植物油有难闻的特殊气味,是由于植物油发生了酯化反应 |
| C、浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 |
| D、海水淡化可以解决淡水危机,向海水中加入明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | |||||||
| 二 | ② | ③ | ④ | |||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 醇 |
| 醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
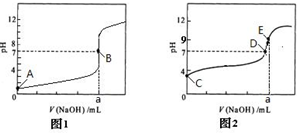
| 组别 | c(一元酸) | c(NaOH)/mol/L | 混合溶液的pH |
| 甲 | c(HX)=0.1mol/L | 0.1 | pH=10 |
| 乙 | c(HY)=0.1mol/L | 0.1 | pH=7 |
| 丙 | c(HZ)=0.1mol/L | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
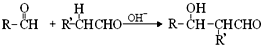 (-R、-R’表示氢原子或烃基)
(-R、-R’表示氢原子或烃基)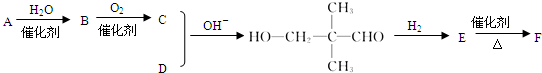
 有一种同分异构体G,G能与Na2CO3反应放出CO2,且分子的核磁共振氢谱只有两个吸收峰,G的结构简式为
有一种同分异构体G,G能与Na2CO3反应放出CO2,且分子的核磁共振氢谱只有两个吸收峰,G的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴有酚酞的Na2CO3溶液 |
| B、溶有SO2的品红溶液 |
| C、滴有石蕊的AlCl3溶液 |
| D、滴有酚酞的饱和Ca(OH)2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com