

| A. | B极中填充多孔的炭或石墨毡,目的是为了增加导电性 | |
| B. | 电池放电时,A极电极反应为:2Na++xS+2 e-=Na2SX | |
| C. | 电池放电时,Na+向电极A极移动 | |
| D. | 电池放电的总反应为2Na+xS=Na2SX,每消耗1molNa转移2mol电子 |
分析 根据图片知,放电时,Na失电子发生氧化反应,所以A作负极、B作正极,负极反应式为2Na-2e-═2Na+、正极反应式为xS+2e-═Sx2-,充电时A为阴极、B为阳极,阴极、阳极电极反应式与负极、正极反应式正好相反,放电时,电解质中阳离子向正极移动、阴离子向负极移动.
解答 解:根据图片知,放电时,Na失电子发生氧化反应,所以A作负极、B作正极,负极反应式为2Na-2e-═2Na+、正极反应式为xS+2e-═Sx2-,充电时A为阴极、B为阳极,阴极、阳极电极反应式与负极、正极反应式正好相反,放电时,电解质中阳离子向正极移动、阴离子向负极移动,
A.B极中填充多孔的炭或石墨毡,目的是为了增加导电性,故A正确;通过以上分析知,放电时,S被还原,故A正确;
B.通过以上分析知,放电时,电极B为正极,xS+2e-═Sx2-,故B错误;
C.放电时,A为负极极、B为正极,Na+由A向B移动,故C错误;
D.电池放电的总反应为2Na+xS=Na2SX,每消耗1molNa转移1mol电,故D错误.
故选:A.
点评 本题考查化学电源新型电池,正确获取图片提供信息是解本题关键,根据得失电子确定正负极、阴阳极,难点是电极反应式的书写,题目难度中等.


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
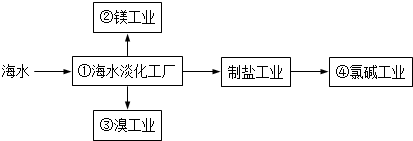
| A. | ①中可采用蒸馏法 | B. | ②中可通过电解法制金属镁 | ||
| C. | ③中提溴涉及到复分解反应 | D. | ④的产品可生产盐酸、漂白液等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 g H218O与10 g D2O所含的中子数均为5NA | |
| B. | 2.4 g Mg在空气中充分燃烧,转移电子数为0.2NA | |
| C. | l L0.1 mol•L-l NH4Cl溶液中所含NH4+数为0.1NA | |
| D. | 100 g质量分数为46%的酒精水溶液中含氧原子总数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 除去乙烷中少量乙烯 | 将混合气体通入酸性高锰酸钾溶液 |
| B | 检验乙醇和乙酸溶液 | 分别在乙醇和乙酸中加入氢氧化钠溶液 |
| C | 制备少量氯化氢气体 | 向浓硫酸中滴加浓盐酸 |
| D | 证明Fe 3+的氧化性比Cu2+强 | 在氯化铜溶液中加入铁粉、振荡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| B. | 煤的气化和液化能提高煤的利用率、减少污染 | |
| C. | 利用Al2O3制作的坩埚,可用于熔融烧碱 | |
| D. | 煤的干馏、石油的分馏为物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四种元素的原子半径大小为Z>Y>X>W | |
| B. | 元素W与氢形成的原子比为1:1的化合物只有2种 | |
| C. | X、Y、Z的最高价氧化物对应的水化物能相互反应 | |
| D. | 由Y与Z组成的化合物在熔融时能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
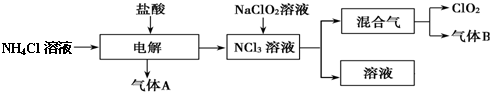
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
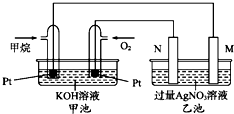 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时,M、N两个电极的质量都不减少,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com