
分析 自发进行的放热的氧化还原反应能设计成原电池;在氧化还原反应中失电子化合价升高的金属作负极、不如负极活泼的金属或导电的非金属作正极,得电子发生还原反应的电解质为该原电池电解质.
解答 解:(1)A中反应前后各元素化合价不变,所以不属于氧化还原反应,属于复分解反应,B中Fe元素化合价由0价变为+2价、H元素化合价由+1价变为0价,所以Fe发生氧化反应作负极,电极反应式为Fe-2e-=Zn2+,能设计成原电池,故答案为:B;Fe-2e-=Fe2+;
(2)能设计成的反应必须是自发进行的放热的氧化还原反应,A的反应为非氧化还原反应,没有电子转移,所以不能设计成原电池,故答案为:A;该反应为非氧化还原反应,没有电子转移.
点评 本题考查了原电池设计,明确原电池反应特点、正负极及电解质溶液的判断方法即可解答,在原电池反应中,一般来说,失电子化合价升高的金属单质作负极、得电子化合价降低的电解质为电解质溶液中的电解质,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
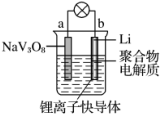 水系锂电池具有安全、环保和价格低廉等优点,成为当前电池研究领域的热点. 以钒酸钠(NaV3O8)为正极材料的电极反应式为NaV3O8+xLi++xe-═NaLixV3O8,则下列说法不正确的是( )
水系锂电池具有安全、环保和价格低廉等优点,成为当前电池研究领域的热点. 以钒酸钠(NaV3O8)为正极材料的电极反应式为NaV3O8+xLi++xe-═NaLixV3O8,则下列说法不正确的是( )| A. | 放电时,负极的电极反应式:Li-e-═Li+ | |
| B. | 该电池可以用硫酸钠溶液作电解质 | |
| C. | 充电过程中阳极的电极反应式:NaLixV3O8-xe-═NaV3O8+xLi+,NaLixV3O8中钒的化合价发生变化 | |
| D. | 充电过程中Li+从阳极向阴极迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ⑤⑥ | C. | ④⑥ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沸点/℃ | 水溶性 | |
| 甲醇 | 65 | 与水混溶 |
| 甲醛 | -21 | 与水混溶 |
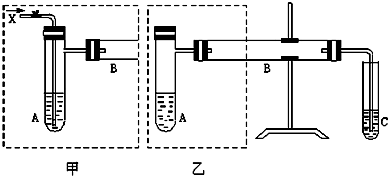
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2CO3?2H++CO32- | B. | CH3COOH═CH3COO-+H+ | ||
| C. | AgCl═Ag++Cl- | D. | NaHCO3═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖 | |
| B. | 淀粉、纤维素、油脂、蛋白质都属于高分子化合物 | |
| C. | 利用油脂在酸性条件下的水解,可以制得甘油和肥皂 | |
| D. | 蛋白质水解的最终产物是氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NF3是氧化剂,H2O是还原剂 | |
| B. | NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 | |
| C. | 一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染 | |
| D. | 若生成0.2 mol HNO3,则转移0.2 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com