
【题目】常温下,一定浓度的某溶液由水电离出的c(OH﹣)=10﹣4 mol/L,则该溶液的溶质可能是( )
A.AlCl3B.NaOHC.Na2CO3D.NaHSO4
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】根据分子结构与性质相关知识,回答下列问题:
(1)NH3分子的VSEPR模型为______________;SO2分子的立体构型为:_______________;
(2)根据等电子原理,写出CN-的电子式_______;SCN-中心原子的杂化方式为 ________;
(3)向CuSO4溶液中逐渐滴加氨水至过量,现象为:__________________________;写出该过程中依次发生的反应离子方程式:_________________________,并写出[Cu(NH3)4]2+的结构简式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离或提纯物质的方法正确的是( )
A. 用蒸馏的方法制取蒸馏水
B. 用过滤的方法除去NaCl溶液中含有的少量Na2SO4
C. 用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D. 用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推法在化学学习中经常采用,下列类推的结论正确的是()
A. 由Cl2+2KBr═2KCl+Br2所以F2也能与KBr溶液反应置换出Br2
B. 常温下,由Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O,所以Fe也能与浓硝酸反应产生NO2
C. 由Cu+Cl2![]() CuCl2所以Cu+I2
CuCl2所以Cu+I2![]() CuI2
CuI2
D. 由钠保存在煤油中,所以钾也可以保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-1、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)硫离子的结构示意图_____________。
(2)黑火药爆炸时,发生的反应之一为:S+2KNO3+3C![]() K2S+3CO2↑+N2↑该反应中1mol S能氧化C_______mol。
K2S+3CO2↑+N2↑该反应中1mol S能氧化C_______mol。
(3)将硫化氢气体与二氧化硫气体在集气瓶中混合发生反应,现象____________。二氧化硫呈现______________(选填“氧化性”、“还原性”)。
(4)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。
以下是二氧化硫形成酸雨的两种途径:
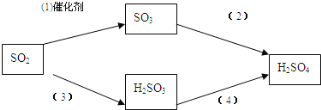
请分别写出(1)和(4)的化学方程式: ________________, ___________________。
(5)你认为减少酸雨产生的途径可采用的措施是_______________。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A. ①②③ B. ②③④ C. ①③⑤ D. ①③④⑤
(6)硫酸盐的种类很多,且应用广泛,医疗上常用_______(写化学式)作X射线透视肠胃的内服药剂,生活用水可以用_________(写化学式)作净水剂。
(7)有化学反应2SO2(g)+O2(g)![]() 2SO3(g) △H=-190kJ/mol,450℃往2L密闭容器中充入2mol SO2和1mol O2,5分钟后的SO2物质的量为0.5mol,则在5min内,用消耗的O2表示的反应速率为_____________________。在其它条件不变时,扩大容器体积,v(正)_______(选填“增大”或“减小”或“不变”),v(逆)______(选填“增大”或“减小”或“不变”)。
2SO3(g) △H=-190kJ/mol,450℃往2L密闭容器中充入2mol SO2和1mol O2,5分钟后的SO2物质的量为0.5mol,则在5min内,用消耗的O2表示的反应速率为_____________________。在其它条件不变时,扩大容器体积,v(正)_______(选填“增大”或“减小”或“不变”),v(逆)______(选填“增大”或“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在有机物的分子中引入羟基的反应类型有( )
①酯化反应;②取代反应;③消去反应;④加成反应;⑤水解反应;⑥还原反应。
A.①②③④B.①②④⑤C.②④⑤⑥D.②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在工农业生产和日常生活中有重要用途。

(1)上图为海带制碘的流程图。步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是_____________(从下列仪器中选出所需的仪器,用标号字母填写)。
A.烧杯B.坩埚C.表面皿D.泥三角E.酒精灯F.冷凝管
步骤④发生反应的离子方程式为____________________________________。
(2)若步骤⑤采用裂化汽油提取碘,后果是__________________________。
(3)溴化碘(IBr)的化学性质类似于卤素单质,如能与大多数金属反应生成金属卤化物,跟水反应的方程式为:IBr+H2O==HBr+HIO等,下列有关IBr的叙述中错误的是(____)。
A.固体溴化碘熔沸点较高
B.在许多反应中,溴化碘是强氧化剂
C.跟卤素单质相似,跟水反应时,溴化碘既是氧化剂,又是还原剂
D.溴化碘跟NaOH溶液反应生成NaBr、NaIO和H2O
(4)为实现中国消除碘缺乏病的目标。卫生部规定食盐必须加碘盐,其中的碘以碘酸钾(KIO3)存在。可以用硫酸酸化的碘化钾淀粉溶液检验加碘盐,下列说法正确的是(____)。
A.碘易溶于有机溶剂,可用酒精萃取碘水中的I2
B.检验加碘盐原理:IO3—+5I—+3H2O ===3I2+6OH—
C.在KIO3溶液中加入几滴淀粉溶液,溶液变蓝色
D.向某无色溶液中加入氯水和四氯化碳,振荡,静置,下层呈紫色,说明原溶液中有I—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com