
 在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )
在25℃下,稀释HA、HB两种酸溶液,溶液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积.下列说法正确的是( )| A. | lg$\frac{{V}_{2}}{{V}_{1}}$=6时,HA溶液的pH=8 | |
| B. | pH相同时,c(HA)>c(HB) | |
| C. | 曲线上a、b两点 $\frac{[{B}^{-}]}{[HB][O{H}^{-}]}$ 一定不相等 | |
| D. | 25℃时,NaA溶液的pH一定小于NaB溶液 |
分析 在25℃下,稀释HA、HB两种酸溶液PH=2,加水稀释lg$\frac{{V}_{2}}{{V}_{1}}$=2,稀释100倍,HA溶液PH=4,说明HA为强酸,溶液HB的PH<4,说明HB为弱酸,、
A.HA为强酸lg$\frac{{V}_{2}}{{V}_{1}}$=6时,稀释106,此时需要考虑水的电离,溶液PH接近7;
B.HA为强酸,HB为弱酸分析;
C.$\frac{c({B}^{-})}{c(HB)c(O{H}^{-})}$=$\frac{c({B}^{-})}{c(HB)c(O{H}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{Kw}$;
D.HA为强酸,HB为弱酸,25℃时,NaA溶液的pH=7,NaB溶液PH>7;
解答 解:A.在25℃下,稀释HA、HB两种酸溶液PH=2,加水稀释lg$\frac{{V}_{2}}{{V}_{1}}$=2,稀释100倍,HA溶液PH=4,说明HA为强酸,溶液HB的PH<4,说明HB为弱酸,、
A.HA为强酸lg$\frac{{V}_{2}}{{V}_{1}}$=6时,稀释106,此时需要考虑水的电离,溶液PH接近7,不可能变化为碱,故A错误;
B.HA为强酸,HB为弱酸存在电离平衡,pH相同时,c(HA)<c(HB),故B错误;
C.曲线上a、b两点$\frac{c({B}^{-})}{c(HB)c(O{H}^{-})}$=$\frac{c({B}^{-})}{c(HB)c(O{H}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Ka}{Kw}$,温度不变比值一定不变,故C错误;
D..HA为强酸,HB为弱酸,25℃时,NaA是强酸缺考盐溶液的pH=7,NaB溶液中B-离子水解溶液显碱性PH>7,NaA溶液的pH一定小于NaB溶液,故D正确;
故选D.
点评 本题考查了弱电解质电离平衡、溶液PH变化的分析判断、电离平衡常数和离子积常数的含义、盐类水解等知识点,掌握基础是解题关键,题目难度中等.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③④⑥ | B. | ①③④⑤ | C. | ①③⑤⑥ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 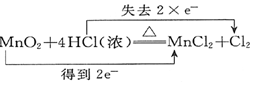 ↑+2H2O ↑+2H2O | B. | 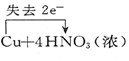 (浓)═Cu(NO3)2+2NO2↑+2H2O (浓)═Cu(NO3)2+2NO2↑+2H2O | ||
| C. | 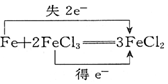 | D. | 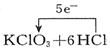 ═KCl+3Cl2↑+3H2O ═KCl+3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向K2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原K2CO3的物质的量之比为1:2 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | 向明矾溶液里滴加氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,铝元素的存在形式是一部分为Al(OH)3沉淀,一部分以A1O2-形式存在于溶液中 | |
| D. | 加入A1放出H2的溶液中可能大量存在Fe3十、K十、C1一、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 480mL 56.2g | B. | 500mL 58.5g | ||
| C. | 1000mL 58.5g | D. | 任意规格 56.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验方案 | 实验现象 | 化学方程式 |
| ① | 将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳溶液,振荡、静置 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层变为橙红色 | Cl2+2NaBr=2NaCl+Br2 |
| ② | 将少量溴水加入盛有碘化钾溶液的试管中,用力振荡后加入少量四氯化碳溶液,振荡、静置 | 加入溴水后,溶液由无色变为褐色,滴入四氯化碳后,水层颜色变浅,四氯化碳层变为紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在浓度大的盐酸中反应产生的气体多 | |
| B. | 一样多 | |
| C. | 在浓度小的盐酸中反应产生的气体多 | |
| D. | 由反应的剧烈程度决定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com