
| A. | H2O | B. | NH3•H2O | C. | CH3COOH | D. | NaCl |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
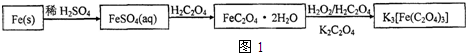
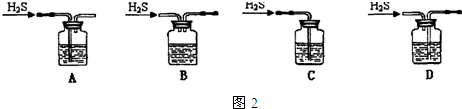
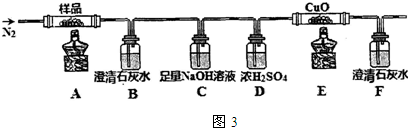
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
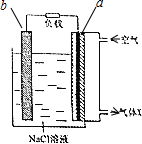 镁-空气电池的工作原理如图所示.下列说法不正确的是( )
镁-空气电池的工作原理如图所示.下列说法不正确的是( )| A. | 工作一段时间后,c(Na+)变大 | B. | 气体X中N2的百分量与空气相同 | ||
| C. | 电池工作时,OH-向a极移动 | D. | 电池总反应为2Mg+O2+2H2O═2Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
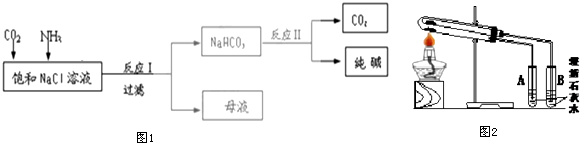
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 外观 | 熔点 | 燃烧热/(kJ•mol-1) |
| 金刚石 | 无色,透明固体 | ? | 395.4 |
| 石墨 | 灰黑,不透明固体 | ? | 393.5 |
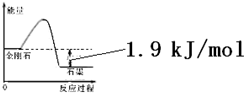
| A. | 由表中信息可得如右图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol | |
| C. | 由表中信息可推知相同条件下金刚石的熔点低于石墨的熔点 | |
| D. | 表示石墨燃烧热的热化学方程式为C(石墨,s)+$\frac{1}{2}$O2(g)=CO(g)△H=-393.5kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
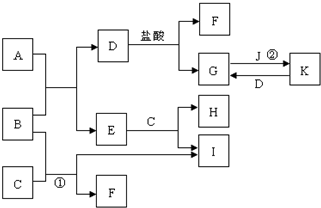 如图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去. A俗称“铁红”,B、D都是日常生活中常见的金属,且B元素是地壳中含量最多的金属元素,常温下,J为黄绿色气体,H为无色气体;C是一种碱,且其焰色反应时,透过蓝色钴玻璃可观察到紫色火焰.
如图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去. A俗称“铁红”,B、D都是日常生活中常见的金属,且B元素是地壳中含量最多的金属元素,常温下,J为黄绿色气体,H为无色气体;C是一种碱,且其焰色反应时,透过蓝色钴玻璃可观察到紫色火焰.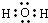 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com