
 利用如图装置可验证同主族元素非金属性的变化规律
利用如图装置可验证同主族元素非金属性的变化规律| 题号 | 实 验 要 求 | 答案 |
| ① | 从碘水中提取碘单质 | |
| ② | 提纯混有少混NaCl的KNO3 | |
| ③ | 鉴别NaCl和KCl | |
| ④ | 检验自来水中残余氯分子 |


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
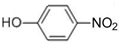 ⑥
⑥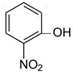 ⑦I2 ⑧H2O2 ⑨SiO2 ⑩NH4Cl
⑦I2 ⑧H2O2 ⑨SiO2 ⑩NH4Cl查看答案和解析>>
科目:高中化学 来源: 题型:
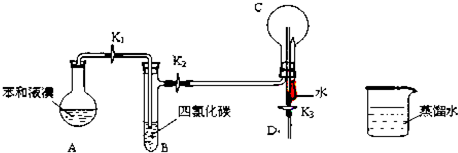
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
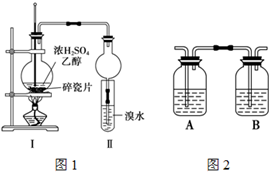 某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将钠投入硫酸铜溶液中只有紫红色固体析出 |
| B、过氧化钠投入硫酸亚铁溶液中出现白色沉淀 |
| C、氨水滴入氯化铝溶液中先出现白色沉淀后溶解 |
| D、饱和氯化钙溶液加入浓氢氧化钠溶液出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
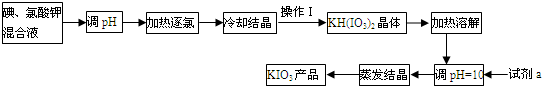
A、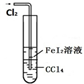 可以用于比较Fe3+、I2、Cl2的氧化性强弱 |
B、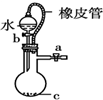 橡皮管的作用是使水能顺利流下 |
C、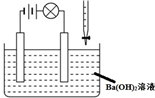 若向Ba(OH)2溶液中逐滴加入硫酸溶液直至过量,灯光会由亮变暗至熄灭后又逐渐变亮 |
D、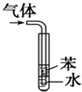 用于吸收HCl气体能防倒吸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com