
| A、Na2CO3=Na2++CO32- | B、NaHSO4=Na++H++SO42- | C、KClO3=K++Cl-+3O2- | D、NaOH=Na++H++O2- |
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:阅读理解
 H++B(OH)4-,该反应中的碱是
H++B(OH)4-,该反应中的碱是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+| CO | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.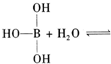
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省武汉二中高二下学期期中考试化学试卷(带解析) 题型:填空题
碳是形成化合物最多的元素。
(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体。下列关于分子晶体和原子晶体的说法正确的是 (填字母序号)。
A、完全由非金属元素形成的物质一定是分子晶体或原子晶体
B、分子晶体中分子之间一定存在范德华力
C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力
D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如图所示。下列说法正确的是 。
A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体
C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形
(3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为 。
(4)邻硝基苯酚的熔点 对硝基苯酚(填“>”、“=”或“<”=)。
(5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素。下列有关的四种化合物中,键角最小的是 。
A、CO2 B、CF4 C、NF3 D、OF2
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因。
请写出下面这个方程式右端的两种离子的表达式: 。
。
查看答案和解析>>
科目:高中化学 来源:2014届湖北省高二下学期期中考试化学试卷(解析版) 题型:填空题
碳是形成化合物最多的元素。
(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体。下列关于分子晶体和原子晶体的说法正确的是 (填字母序号)。
A、完全由非金属元素形成的物质一定是分子晶体或原子晶体
B、分子晶体中分子之间一定存在范德华力
C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力
D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如图所示。下列说法正确的是 。

A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体
C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形
(3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为 。
(4)邻硝基苯酚的熔点 对硝基苯酚(填“>”、“=”或“<”=)。
(5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素。下列有关的四种化合物中,键角最小的是 。
A、CO2 B、CF4 C、NF3 D、OF2
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因。
请写出下面这个方程式右端的两种离子的表达式:
 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com