
 铬元素及其化合物在生产、生活中具有广泛的用途.
铬元素及其化合物在生产、生活中具有广泛的用途.分析 (1)铜排在金属活动性顺序表中H的后面,不能与硫酸反应,据此解答即可;
(2)氢氧化铝与氢氧化钾反应生成偏铝酸钾和水,据此书写;
(3)①阴极上是阳离子发生得电子的还原反应,据此书写电极反应;
②Fe3+、Cr3+在水溶液中会发生水解反应,当溶液的碱性达到一定程度就会生成氢氧化物沉淀;
③根据电解后溶液中c(Fe3+),由KsP[Fe(OH)3]计算溶液中c(OH-),再根据KsP[Cr(OH)3]计算溶液中c(Cr3+);
(4)根据化合价升降总数相等以及原子守恒来解答;
(5)根据质量守恒定律,在变化过程中,Co的质量没有变,求出氧原子和铬原子的个数比即可.
解答 解:(1)在常温下,铬能缓慢与稀硫酸反应,而Cu不能与稀硫酸反应,说明Cr金属活泼性较强,故答案为:强;
(2)Cr(OH)3和Al(OH)3类似,氢氧化铝与氢氧化钾反应生成偏铝酸钾和水,故Cr(OH)3与KOH反应生成KCrO2,离子反应方程式为:Cr(OH)3+OH-=CrO2-+2H2O,
故答案为:Cr(OH)3+OH-=CrO2-+2H2O;
(3)①用Fe为电极进行电解,阳极是活泼电极,则电极本身发生失电子的氧化反应,即Fe-2e-═Fe2+,阴极上是阳离子发生得电子的还原反应,即2H++2e-═H2↑,
故答案为:2H++2e-═H2↑;
②在电解池的阳极:Fe-2e-═Fe2+,Cr2O72-具有强氧化性,可以将亚铁离子氧化为铁离子,自身被还原为2Cr3+,反应的实质是:6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O,Cr2O72-与Fe2+反应的过程中,将消耗大量的H+,使溶液pH上升,促使Fe3+、Cr3+水解并最终转化为Fe(OH)3、Cr(OH)3沉淀,
故答案为:阳极Fe-2e-=Fe2+,6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,消耗H+,同时阴极H+放电,c(OH-)增大,Fe3+、Cr3+结合OH-转化为沉淀;
③电解后溶液中c(Fe3+)=2.0×10-13mol/L,则溶液中c3(OH-)=$\frac{4×1{0}^{-38}}{2×1{0}^{-13}}$mol/L=2×10-25mol/L,故溶液中c(Cr3+)=$\frac{6×1{0}^{-31}}{2×1{0}^{-25}}$mol/L=3×10-6mol/L,
故答案为:3×10-6;
(4)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,碳的平均化合价从-2价升高到0,1个乙醇化合价变化4,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3],铬的化合价从+6价降低到+3价,1个CrO3化合价变化3,两者的最小公倍数是12,再根据原子守恒得:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3CO0H+9H2O,
故答案为:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3CO0H+9H2O;
(5)设CrO3的质量为100g,则CrO3中铬元素的质量为:100g×$\frac{52}{52+16×3}$=52g,B点时固体的质量为:100g×76%=76g,Co的质量没有变,所以生成物中Co的质量为52g,氧元素的质量为16,两者的个数比为$\frac{52}{52}$=2:3,所以B点时剩余固体的成分是Cr2O3,
故答案为:Cr2O3.
点评 本题考查了离子方程式和电极反应式的书写,注意(5)题中,在变化过程中,Co的质量没有变,是解题的关键,题目难度中等.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
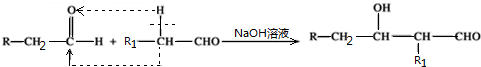
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 组 分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
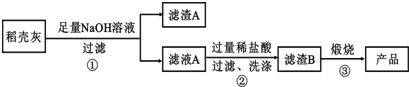
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | K |
| 973K | 1.47 |
| 1173K | 2.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1 的NH4NO3溶液中含有的NO-3数目为0.3NA | |
| B. | 常温常压下,5.6gC2H4和C3H6的混合气体中含氢原子数为0.9NA | |
| C. | 将标准状况下11.2L的Cl2通入足量水中,转移的电子总数为0.5NA | |
| D. | 一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com