
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。

(1)按图连接好实验装置。检查装置的气密性,方法是_____________________
______________________________________________________________________。
(2)反应过程中末端导管必须始终插入试管A的水中,目的是_______________________
_______________________________________。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后,__________________;④拆除装置,取出产物。
(4)数据记录如下:
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
①计算得到实验式CaxN2,其中x=_______________________。
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:_________________
___________________________________________________________________。
【答案】
(1)活塞K,微热反应管,试管A中有气泡冒出,停止加热。冷却后若末端导管中水柱上升且高度保持不变,则说明装置气密性良好
(2)防止反应过程中空气进入反应管;便于观察N2流速
(3)熄灭酒精灯,待反应管冷却至室温,停止通N2,并活塞K
(4)①2.80 ②O2和N2分别与等量的Ca反应,生成CaO的质量高于Ca3N2。若通入的N2中混有少量O2,会导致计算出的n(N)偏大,所以n(Ca)/n(N)<3/2,即x<3
【解析】本题考查实验操作、实验计算及误差分析。(3)Ca3N2能与水反应,所以反应完成后,通N2以防Ca3N2与水反应,影响测定结果。
(4)①m(Ca)=15.08 g-14.80 g=0.28 g
m(N2)=15.15 g-15.08 g=0.07 g
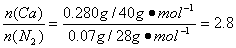
即x=2.8


科目:高中化学 来源: 题型:
白磷与氧可发生如下反应:P4+5O2=P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P akJ·mol-1、P-O bkJ·mol-1、P=O ckJ·mol-1、O=O dkJ·mol-1

根据图示的分子结构和有关数据估算该反应的 H,其中正确的是
H,其中正确的是
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
高纯 是制备高性能磁性材料的主要原料。实验室以
是制备高性能磁性材料的主要原料。实验室以 为原料制备少量高纯
为原料制备少量高纯 的操作步骤如下:(1)制备
的操作步骤如下:(1)制备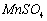 溶液:
溶液:
在烧瓶中(装置见右图)加入一定量 和水,搅拌,通入
和水,搅拌,通入 和
和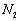 混合气体,反应3h。停止通入
混合气体,反应3h。停止通入 ,继续反应片刻,过滤(已知
,继续反应片刻,过滤(已知 )。
)。
①石灰乳参与反应的化学方程式为 。

 ②反应过程中,为使
②反应过程中,为使 尽可能转化完全,在通入
尽可能转化完全,在通入 和
和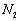 比例一定、不改变固液投料的条件下,可采取的合理措施有 、 。
比例一定、不改变固液投料的条件下,可采取的合理措施有 、 。
③若实验中将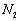 换成空气,测得反应液中
换成空气,测得反应液中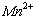 、
、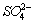 的浓度随反应时间t变化如右图。导致溶液中
的浓度随反应时间t变化如右图。导致溶液中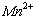 、
、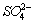 浓度变化产生明显差异的原因是 。
浓度变化产生明显差异的原因是 。
(2)制备高纯 固体:已知
固体:已知 难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;
难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解; 开始沉淀时
开始沉淀时 。请补充由(1)制得的
。请补充由(1)制得的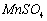 溶液制备高纯
溶液制备高纯 的操作步骤[实验中可选用的试剂:
的操作步骤[实验中可选用的试剂:  、
、 、
、 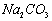 、
、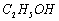 ]。
]。
① ;② ;③ ;④ ;⑤低于100℃干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

(1)溶解大理石时,用硝酸而不用硫酸的原因是___________________。
(2)操作Ⅱ的目的是__________________,溶液A(溶质是共价化合物)是___________________。
(3)写出检验滤液中是否含铁离子的方法:___________________。
(4)写出加入碳酸铵所发生反应的离子方程式:___________________,写出滤液B的一种用途:___________________。
(5)CaO2中一般含CaO。试按下列提示完成CaO2含量分析的实验设计。
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞 仪器:电子天平、锥形瓶、滴定管
实验步骤:
①___________________;②加入___________________;③加入酚酞,用氢氧化钠标准溶液滴定。
(6)若理论上滴定时耗用标准溶液20.00 mL恰好完全反应,实际操作中过量半滴(1 mL溶液为25滴),则相对误差为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸铜可表示为:xCuCO3·yCu(OH)2·zH2O,测定碱式碳酸铜组成的方法有多种。
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式______________________;
②实验装置用下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(l)

③称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为___________g,化学式为___________________;
(2)某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到目的的是( )
A.在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B.用稀硫酸和锌粒反应制氢气时加入少许硫酸铜以加快反应速率
C.用玻璃棒搅拌漏斗中的液体以加快过滤速度
D.加入盐酸以除去硫酸钠中的少量碳酸钠杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
取化学式为MZ的黄色粉末状化合物进行如下实验。将MZ和足量碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水。按图连接仪器。

实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。同时,b瓶的溶液中出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却。此时,管中的熔融物凝固成银白色金属。根据以上叙述回答问题:
(1)元素Z是 :
(2)停止加热前是否需要先断开a和b的连接处?为什么?
;
(3)反应管a中发生的所有反应的化学方程式是
;
(4)本实验的尾气是否需处理?如需处理,请回答如何处理:如不需处理,请说明理由。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到目的的是 ( )
A.在容量瓶中加一定体积的水,再加入浓盐酸配制准确浓度的稀盐酸
B.用稀硫酸和锌粒反应制氢气时加入少许硫酸铜加快反应速率
C.用玻璃棒搅拌漏斗中的液体以加快过滤的速度
D.加入盐酸以除去硫酸钠中的少量碳酸钠杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com