

分析 (1)实验室用加热氯化铵与氢氧化钙的方法制取氯气,依据反应物状态与反应条件选择发生装置,依据氨气密度小于空气密度,易溶于水,选择收集方法,氨气为碱性气体,易溶于水,尾气处理可以用水吸收,注意防止倒吸的发生;
(2)①根据A、B容器压强以及A、B混合后压强相等以及氨气和氯化氢反应生成氯化铵分析;
②氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,氯化铵为强酸弱碱盐,溶液呈酸性,据此分析.
解答 解:(1)实验室用加热氯化铵与氢氧化钙的方法制取氯气,方程式:2NH4Cl(固体)+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,反应物状态为固体+液体,反应条件为加热,所以应选择A做发生装置,氨气密度小于空气密度,易溶于水,应选择向下排空气法收集,所以应选择装置C为收集装置,氨气为碱性气体,易溶于水,尾气处理可以用水吸收,容易发生倒吸,为防止倒吸应选择装置G为尾气处理装置;
故答案为:2NH4Cl(固体)+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;ACG;
(2)①A容器压强为150KPa,B容器压强100KPa,A容器压强大于B容器,先打开旋塞1,A容器中的氯化氢进入B容器,氨气和氯化氢反应,NH3+HCl=NH4Cl,生成氯化铵固体小颗粒,所以B瓶中的现象是出现白烟,
故答案为:产生白烟;NH3+HCl=NH4Cl;
②氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,再打开旋塞2,紫色的石蕊试液倒吸入B瓶中,氯化铵为强酸弱碱盐,溶液中铵根离子水解生成一水合氨和氢离子,水解方程式为:NH4++H2O?NH3•H2O+H+,溶液呈酸性,所以紫色石蕊试液变红,
故答案为:烧瓶中的液体倒吸入B瓶,且紫色石蕊试液变红.
点评 本题考查了氨气的实验室制备及氨气性质的检验,掌握实验室制取氨气的制备原理和性质是解题关键,题目难度不大.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:实验题
 如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:
如图,p、q为直流电源两极,A由+2价金属单质X制成,B、C、D为铂电极,接通电源,金属X沉积于B极,同时C、D产生气泡.试回答:| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 阴极生成 气体体积(cm3) | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 | 79 | 89 |
| 阳极生成 气体体积(cm3) | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | d元素最高价氧化物对应的水化物酸性比c最高价氧化物对应的水化物酸性强 | |
| B. | e与氢气化合比b与氢气化合更容易 | |
| C. | a元素的氢化物是离子化合物 | |
| D. | c在空气中点燃可生成其最高价氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据金属失去电子的多少来判断,失去电子较多的金属性较强 | |
| B. | 用钠置换MgCl2溶液中的Mg2+,来验证钠的金属性强于Mg | |
| C. | Mg不与NaOH溶液反应而Al能与NaOH溶液反应,可说明金属性:Al>Mg | |
| D. | 碱性:NaOH>Mg(OH)2>Al(OH)3,可说明钠、镁、铝金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
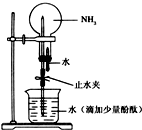 有关氨的实验室制取和性质实验如下:
有关氨的实验室制取和性质实验如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com